
| A. | 有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大 | |
| B. | 对某一达到化学平衡状态的反应,若外界条件使反应速率改变,平衡一定会移动 | |
| C. | 在电解精炼铜的过程中,电解液中c(Cu2+)减小 | |
| D. | 500℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g)放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-11 |
分析 A.增大压强,活化分子数目不变;
B.如正逆反应速率相等,则平衡不移动;
C.阳极为粗铜,阳极可氧化铁、锌等金属,阴极只析出铜;
D.氮气和氢气的反应为可逆反应.
解答 解:A.增大压强,单位体积的活化分子数目增加,但活化分子数目不变,故A错误;
B.如正逆反应速率相等,则平衡不移动,如加入催化剂等,故B错误;
C.阳极为粗铜,阳极可氧化铁、锌等金属,阴极只析出铜,则电解液中c(Cu2+)减小,故C正确;
D.氮气和氢气的反应为可逆反应,则生产2mol氨气放出的热量大于38.6kJ,故D错误.
故选C.
点评 本题考查化学平衡的移动、化学反应速率的影响以及热化学方程式等知识,为高频考点,侧重考查学生的分析能力,主要相关知识的理解,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2d | B. | 2.5d | C. | 5d | D. | 0.8d |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
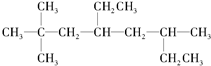 烃A的一氯代物具有不同沸点的产物有10种.
烃A的一氯代物具有不同沸点的产物有10种.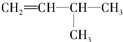 的系统名称是3-甲基-1-丁烯,将其在催化剂存在下完全氢化,所得烷烃的系统名称是2-甲基丁烷.
的系统名称是3-甲基-1-丁烯,将其在催化剂存在下完全氢化,所得烷烃的系统名称是2-甲基丁烷.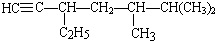 的系统名称是5,6-二甲基-3-乙基-1-庚烯,将其在催化剂存在条件下完全氢化,所得烷烃的系统名称为2,3-二甲基-5-乙基-庚烷.
的系统名称是5,6-二甲基-3-乙基-1-庚烯,将其在催化剂存在条件下完全氢化,所得烷烃的系统名称为2,3-二甲基-5-乙基-庚烷.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间/min | 0 | 10 | 20 | 40 | 50 | |
| T1 | n(CH4)/mol | 1.00 | 0.70 | 0.50 | 0.20 | 0.20 |
| T2 | n(CH4)/mol | 1.00 | 0.60 | 0.36 | … | 0.30 |
| A. | T2时NO2的平衡转化率为70.0% | |
| B. | 该反应的△H<0、T1<T2 | |
| C. | 保持其他条件不变,T1时向平衡体系中再充入1.00molCH4和2.40molNO2,与原平衡相比,达新平衡时N2的浓度增大、体积分数减小 | |
| D. | 保持其他条件不变,T1时向平衡体系中再充入0.60molCH4和1.60molH2O(g),平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 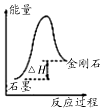 如图所示,从能量角度考虑,石墨比金刚石稳定 | |
| B. | 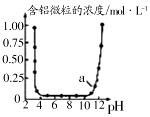 图表示Al3+与OH-反应时含铝微粒浓度变化曲线,图中a点溶液中大量存在Al3+ | |
| C. | 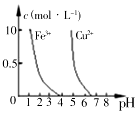 如图所示,若除去CuSO4溶液中的Fe3+,可向溶液中加入适量NaOH溶液,调节pH≈4 | |
| D. | 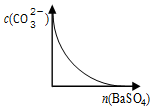 如图所示,在饱和Na2CO3溶液中逐步加BaSO4固体后,溶液中c(CO32-)的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
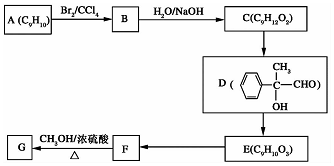
 .
.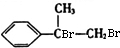 +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$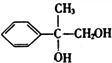 +2NaBr
+2NaBr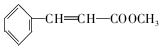 互为同分异构体
互为同分异构体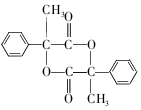 合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3.
合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3.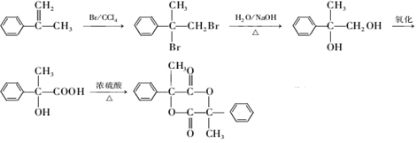 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气的燃烧热为285.5 kJ•mol-1,则水分解的热化学方程式为2H2O(l)═2H2(g)+O2(g)△H=+285.5 kJ•mol-1 | |
| B. | 已知2C(石墨,s)+O2(g)═2CO(g)△H=-221 kJ•mol-1,则石墨的燃烧热为 110.5 kJ•mol-1 | |
| C. | 已知N2(g)+3H2(g)?2NH3(g)△H=-92.4 kJ•mol-1,则在一定条件下将1 mol N2和3 mol H2置于一密闭容器中充分反应后最多可放出92.4 kJ的热量 | |
| D. | 已知乙醇和乙烯的燃烧热分别为1 366.8 kJ•mol-1和1 411.0 kJ•mol-1,则乙烯水化制乙醇的热化学方程式为C2H4(g)+H2O(l)═C2H5OH(l)△H=-44.2 kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com