
下列反应: ①SO2通入氢硫酸中 ②SO2通入氯水中 ③F2通入水中 ④Cl2通入NaOH溶液中,其中通入的气体只作氧化剂 的是
A.只有③ B.只有①② C.只有①③ D.只有②④
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 (2010?山东)硫一碘循环分解水制氢主要涉及下列反应:
(2010?山东)硫一碘循环分解水制氢主要涉及下列反应: H2+I2
H2+I2 2HI(g)的平衡常数K=
2HI(g)的平衡常数K=查看答案和解析>>
科目:高中化学 来源: 题型:
![]()
已知常压下SO3体积分数为91%,试回答:?
(1)在生产中常用过量的空气是为了 。?
(2)加热到400~
(3)压强应采用(填“高压”或“常压”) ,原因是? 。?
(4)常用浓H2SO4来吸收SO3,而不是用水,是因为 。?
(5)尾气中的SO2必须回收,是因为 。?
查看答案和解析>>
科目:高中化学 来源:2013届辽宁省实验中学分校高三12月月考化学试卷(带解析) 题型:填空题
(10分)硫—碘循环分解水制氢主要涉及下列反应:
Ⅰ. SO2+2H2O+I2===H2SO4+2HI
Ⅱ. 2HI H2+I2
H2+I2
Ⅲ. 2H2SO4===2SO2+O2+2H2O
(1) 分析上述反应,下列判断正确的是 。
a.反应Ⅲ易在常温下进行
b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程产生1 mol O2的同时产生1 mol H2
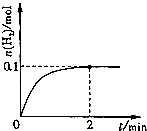
(2) 一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。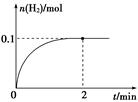
① 0~2 min内的平均反应速率v(HI)= 。
② 该温度下,H2(g)+I2(g) 2HI(g)的平衡常数K= 。
2HI(g)的平衡常数K= 。
③ 相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则 是原来的2倍。
a.平衡常数 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数
(3) 实验室用Zn和稀硫酸制取H2,反应时若加入少量下列试剂中的 ,产生H2的速率将增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
查看答案和解析>>
科目:高中化学 来源:2012年沪科版高中化学6.1提示化学反应速率和平衡之谜练习卷(带解析) 题型:填空题
在硫酸工业中,通过下列反应使SO2转化为SO3:2SO2+O2 2SO3,ΔH<0,已知常压下平衡混合气体中SO3体积分数为91%。试回答:?
2SO3,ΔH<0,已知常压下平衡混合气体中SO3体积分数为91%。试回答:?
(1)在生产中常用过量的空气是为了____________________________________。
(2)加热到400℃~500℃是由于_____________________________________。
(3)压强采用______________,原因是__________________________________。
(4)常用浓H2SO4来吸收SO3而不用水,因为____________________________。
查看答案和解析>>
科目:高中化学 来源:2012届度江西省上学期高三期末考试化学试卷 题型:填空题
(8分)硫一碘循环分解水制氢主要涉及下列反应:
Ⅰ SO2+2H2O+I2===H2SO4+2HI
Ⅱ 2HI H2+I2
H2+I2
Ⅲ 2H2SO4===2SO2↑+O2↑+2H2O
(1)分析上述反应,下列判断正确的是 。
a.反应Ⅲ易在常温下进行
b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程中产生1mol O2的同时产生1mol H2
(2)一定温度下,向1L密闭容器中加入1mol HI(g)
发生反应Ⅱ,H2物质的量随时间的变化如图所示。
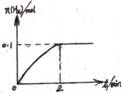
0~2 min内的平均反应速率v(HI)= 。
该温度下,H2(g)+I2(g)  2HI(g)的平衡常数K= 。
2HI(g)的平衡常数K= 。
相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则 是原来的2倍。
a.平衡常数 b.HI的平衡浓度 c.达到平衡的时间 d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡 移动(填“向左”“向右”或者“不”);若加入少量下列试剂中的 ,产生H2的速率将增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(4)以H2为燃料可制成氢氧燃料电池。
已知 2H2(g)+O2(g)===2H2O(l) △H=-572KJ.mol-1
某氢氧燃料电池释放228.8KJ电能时,生成1mol液态水,该电池的能量转化率为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com