
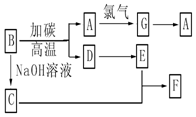
 请回答下列问题:
请回答下列问题:分析 (1)镁在二氧化碳中燃烧生成氧化镁和碳;
(2)Cu作还原剂,双氧水作氧化剂,发生氧化还原反应生成硫酸铜;
(3)Al与NaOH溶液反应,而Fe不能;
(4)B常被用于制造光导纤维,其对应的单质的结构与金刚石相似,则A为Si,B为SiO2,D为CO,由转化关系可知,C为Na2SiO3,E为CO2,F为H2SiO3,G为SiCl4,据此解答.
解答 解:(1)镁在二氧化碳中燃烧生成氧化镁和碳,反应的化学方程式为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C,
故答案为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C;
(2)铜片和稀硫酸放在试管中,再向其中滴入双氧水,发现溶液逐渐呈蓝色,是发生了氧化还原反应所致,该反应为Cu+H2O2+H2SO4═CuSO4+2H2O,
故答案为:Cu+H2O2+H2SO4═CuSO4+2H2O;
(3)铝能够溶于氢氧化钠溶液,反应生成偏铝酸钠和氢气,反应的离子方程式:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,除去铁粉中混有的铝粉可以选择氢氧化钠溶液,
故答案为:氢氧化钠溶液; 2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(4)B常被用于制造光导纤维,其对应的单质的结构与金刚石相似,则A为Si,B为SiO2,D为CO,由转化关系可知,C为Na2SiO3,E为CO2,F为H2SiO3,G为SiCl4,
B→A反应是二氧化硅被碳还原生成硅和一氧化碳,反应的化学方程式为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO,
C+E→F的反应是硅酸钠溶液中通入二氧化碳生成硅酸和碳酸氢钠,反应的化学方程式为:Na2SiO3+2H2O+2CO2═H2SiO3↓+2NaHCO3,
故答案为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO;Na2SiO3+2H2O+2CO2═H2SiO3↓+2NaHCO3.
点评 本题考查了无机物性质、物质转化关系、需要学生熟练掌握元素化合物性质,掌握基础是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 漂白粉可用于养殖业消毒杀菌 | B. | SiO2可用于制光导纤维 | ||
| C. | FeCl3溶液可用于蚀刻铜制线路板 | D. | AlCl3可用于电解冶炼铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ②④ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 于2016年9月15日发射的“天宫二号”空间实验室的供电系统中有再生氢氧燃料电池,工作原理如图所示,下列说法正确的是( )
于2016年9月15日发射的“天宫二号”空间实验室的供电系统中有再生氢氧燃料电池,工作原理如图所示,下列说法正确的是( )| A. | 当有0.1 mol电子转移时,a极产生标准状况下1.12 L H2 | |
| B. | 左端装置中化学能转化为电能,右端装置中电能转化为化学能 | |
| C. | c极上发生的电极反应是:O2+2H2O+4e-=4OH- | |
| D. | d极上进行还原反应,右端装置B中的H+可以通过隔膜进入A池 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有① | B. | ②③ | C. | ①④ | D. | ①② |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肯定不含I- | B. | 肯定不含SO42- | C. | 肯定不含SO32- | D. | 肯定含有NH4+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com