
��Ϊ�˳�ȥKCl��Һ��������Mg2����SO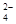 ����ѡ��Ba(OH)2��HCl��K2CO3�����Լ��������²��������
����ѡ��Ba(OH)2��HCl��K2CO3�����Լ��������²�������� 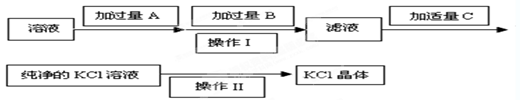
��1�������Լ��У� B�� ��C�� ��
(2)������������� ��
(3)�ӹ���Aʱ�����йط�Ӧ�����ӷ���ʽΪ �� ��
��һ����ɫϡ��Һ�п��ܺ���Na+��Fe3+��H+��Mg2����CO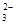 ��OH����HCO
��OH����HCO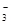 ��Cl���������е������֡�Ϊ��ȷ����Һ����ɣ����������²�����
��Cl���������е������֡�Ϊ��ȷ����Һ����ɣ����������²�����
����ʯ����ֽ����Һ������ԣ���ֽ����ɫ��
��ȡ2������Һ���ȼ�����ϡ�����ữ��������������ټ��Ȼ�����Һ���м��飬û����������
��1��ԭ��Һ��һ�����ڵ������� ��һ�������ڵ������� ��
��2�������������������ܿ϶��Ƿ���ڵ������� ���������һ����ʵ�鷽�����ж��Ƿ�����������ӡ�
��(1)K2CO3��1�֣��� HCl��1�֣��� (2)�����ᾧ��1�֣���
��3��Mg2++2OH��=Mg(OH)2����2�֣�;Ba2++SO42��=BaSO4����2�֣���
��1��Na+,CO32��,OH����2�֣���Fe3+,H+,Mg2+,HCO3����2�֣�����ȫ�Ե�2�֣�©д��1�֣��д����÷֣�
(2)Cl����1�֣��� ȡ����ԭ��Һ����������ϡ�����ữ���ٵμ�����AgNO3,���а�ɫ��������������Cl��,����û�С���2�֣�
�������������
��(1�������������Խ�MgCl2��MgSO4�е����������������ȥ������ʱ��ÿһ�����ӵ��Լ����ǹ����ģ�������������������̼��س�ȥ���������̼���������������ȥ�����Լ�A��B��C������Ba��OH��2��K2CO3��HCl��
��2��Һ��������ķ����ǹ��ˣ����ò���������©�������������ձ������ʵ���Һ��þ���ķ����������ᾧ��
��3�������������Խ�MgCl2��MgSO4�е����������������ȥ������ʽ�ֱ�Ϊ��MgCl2+Ba��OH��2�TBaCl2+Mg��OH��2����MgSO4+Ba��OH��2�TBaSO4��+Mg��OH��2����
��1����ʯ����ֽ����Һ������ԣ���ֽ����ɫ,˵����Һ�ʼ��ԡ���OH-���ӷ�Ӧ�����Ӳ��ܹ��棬Fe3+��H+��Mg2����HCO �ų���������ϡ�����ữ�������������˵������CO
�ų���������ϡ�����ữ�������������˵������CO ������ԭ��Һ��һ�����ڵ�������Na+����Һ�����ٺ���һ�������ӣ�,CO32��,OH����һ�������ڵ�������Fe3+,H+,Mg2+,HCO3���������ܿ϶��Ƿ���ڵ�������Cl����ȡ����ԭ��Һ����������ϡ�����ữ���ٵμ�����AgNO3,���а�ɫ��������������Cl��,����û�С�
������ԭ��Һ��һ�����ڵ�������Na+����Һ�����ٺ���һ�������ӣ�,CO32��,OH����һ�������ڵ�������Fe3+,H+,Mg2+,HCO3���������ܿ϶��Ƿ���ڵ�������Cl����ȡ����ԭ��Һ����������ϡ�����ữ���ٵμ�����AgNO3,���а�ɫ��������������Cl��,����û�С�
���㣺�������ӵļ��鷽��


 ��ĩ100�ִ��غ�������ϵ�д�
��ĩ100�ִ��غ�������ϵ�д� Сѧ�������Ծ�ϵ�д�
Сѧ�������Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�ճ�����ˮ��NO3һ�ĺ�����ˮ�������������Ҫ��֮һ���ﵽһ��Ũ��ʱ������ཡ������Σ����Ϊ�˽�������ˮ��NO3һ��Ũ�ȣ�ij��ȤС��������·�����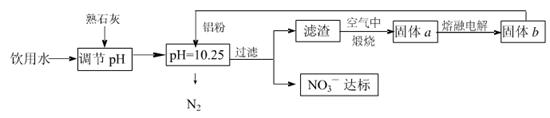
��ش��������⣺
��1���÷����ڵ���pHʱ����pH������С������� �������ʽ��͡�
��2����֪���˺�õ�����Һ�м���������Ԫ�ء�������Һ�����ۺ�NO3һ��Ӧ�����ӷ���ʽΪ ��
�������ڿ��������չ������漰����ط�Ӧ����ʽΪ
��3����H2����ԭ��Ҳ�ɽ�������ˮ��NO3����Ũ�ȣ���֪��Ӧ�еĻ�ԭ���������������ɲ������ѭ���������ԭ�������ӷ���ʽΪ ��
��4������ˮ�е�NO3�� ��Ҫ������NH4������֪�����������£�NH4�� ����������Ӧ��������NO3�� ��������Ӧ�������仯ʾ��ͼ���£�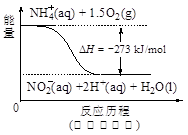

��д��1 mol NH4�� (aq)ȫ��������NO3�� (aq)���Ȼ�ѧ����ʽ�� ��
��5������a���ڵ��ʱ������ӦʽΪ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�裨CN��2�����裨SCN��2�Ļ�ѧ���ʺ�±�غ����ƣ���ѧ�ϳ�Ϊ����±�ء������������ӵĻ�ԭ��ǿ��Ϊ��Cl����Br����CN����SCN����I����
�����
��1����CN��2��KOH��aq����Ӧ�Ļ�ѧ����ʽ���� ����
��2��NaBr��KSCN�Ļ����Һ�м���������CN��2��Ӧ�����ӷ���ʽ���� ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
д�����з�Ӧ�����ӷ���ʽ,����Ӧ�Ļ�ѧ����ʽ��ÿ��2��7С�14�֣�
��1��ʯ��ʯ����ϡ���� ��
��2��ϡ����������������Һ�ķ�Ӧ ��
��3��̼��������Һ�����ᷴӦ ��
��4��������ͭ��ϡ���ᷴӦ ��
��5��2H++ CO32-��CO2��+H2O ��
��6��Cu��2Ag����Cu2����2Ag ��
��7��CO2+2OH-��CO32-+H2O ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�����¼������� ��̼�����ƾ��壻��Һ̬�Ȼ��⣻�����������ǣ����Ҵ��������ڵ�K2SO4���߸ɱ�����ʯī���ᰱ������ջش𣺣�����ţ�
��1�����������ܵ������ ��
��2���������������ڵ���ʵ��� ��
��3���������������ڷǵ���ʵ��� ��
��4����������������ˮ��ˮ��Һ�ܵ������ ��
��5���ֱ�д�����ʢ١�����ˮ��Һ�еĵ��뷽��ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�����¼������ʢٸ����ʳ�ξ��� �ڱ����� ��ˮ�� ������ ��KNO3��Һ
���������ܵ������ ���������������ڵ���ʵ���
�������������ڷǵ���ʵ��� ������ţ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
(1)(4��)д������������ˮ��Һ�еĵ��뷽��ʽ��
HNO3 Ba(OH)2
NaHCO3 NaHSO4
(2)(4��)��ʵ�����Ʊ������Ĺ����У����������ͨ����������������Һ�������գ���д���˷�Ӧ�Ļ�ѧ����ʽ���������ת�Ƶķ������Ŀ��
�û�ѧ��Ӧ�У��������� ����ԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�ӵ�ʳ����ͨ���������KIO3�������������������±��ֳ���ǿ�������ԣ����Ժ͵⻯��������εȻ�ԭ�����ʷ�����Ӧ��
(1)д��KIO3��KI��ϡ��������з�����Ӧ�����ӷ���ʽ______________________
(2)Ϊ�ⶨ�˼ӵ����е�Ԫ�صĺ�����ijѧ�������������ʵ�飺
A��ȷ��ȡwgʳ�Σ�ʹ����ȫ�ܽ�������������ˮ�У�
B����ϡ�����ữ������Һ�����������KI��Һ��ʹ���ַ�Ӧ��
C����___________________Ϊָʾ�����˵μ������ʵ���Ũ��Ϊ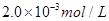 �������������Һ10.0mL��ǡ����ȫ��Ӧ���жϷ�Ӧ��ȫ��ʵ������Ϊ____________________________________,��üӵ�����Ʒ�е�Ԫ�صĺ���Ϊ______________________mg/Kg(�ú�w�Ĵ���ʽ��ʾ)��
�������������Һ10.0mL��ǡ����ȫ��Ӧ���жϷ�Ӧ��ȫ��ʵ������Ϊ____________________________________,��üӵ�����Ʒ�е�Ԫ�صĺ���Ϊ______________________mg/Kg(�ú�w�Ĵ���ʽ��ʾ)��
����֪��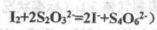 ��
��
(3)ijѧ�����ֽ���������ʵ�飺
A��ȷ��ȡ1.0g������NaCl����3mL����ˮ�����Һ����ҺΪ��ɫ��
B������5��ָʾ����1mL 0.lmol/L Kl��Һ���������Һ���仯��
C�������μ�l��1mol/L��������Һ���������Һ����ɫ
�Ʋ�ʵ���в�����ɫ�����ԭ�������ӷ���ʽ��ʾ________________________
����ѧ���ҵ�ʵ���������ѧ����ʵ�������з�________________________��ƫ��ƫС����ȷ������ԭ����________________________________________________.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ʴ���
��10�֣���ҵ���Ի�����Ϊԭ������������Ҫ��Ϊ�����ν��У������ա������������ա���ش����и����⣺
��1�����ջ������γɵ�¯�����뾭������ϴ�ӡ��������� �����豸���ƣ�
��2���������η�Ӧ2SO2(g)+O2(g)  2SO3(g)����H��0��550 ��ʱ��SO2ת��ΪSO3��ƽ��ת���ʣ���������ϵ��ѹǿ��p���Ĺ�ϵ��ͼ��ʾ��
2SO3(g)����H��0��550 ��ʱ��SO2ת��ΪSO3��ƽ��ת���ʣ���������ϵ��ѹǿ��p���Ĺ�ϵ��ͼ��ʾ��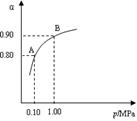
������Ҫ���SO2��ת���ʣ���Ӧ������Ӧ�� �� ����ѹ����ߡ������͡������� ������ͨ������¹�ҵ�����в��ó�ѹ��ԭ���� ��
��2.0 mol SO2��1.0 mol O2����5 ���ܱ������У���Ӧ��ƽ�����ϵ��ѹǿΪ0.10 M Pa���÷�Ӧ��ƽ�ⳣ������ ��
��3��Ϊѭ�����ô�����������Ա����������һ�����ӽ��������շ����¹��գ������ʴ�91.7%���ϡ���֪�Ϸ������к���V2O5��VOSO4�������Բ�������������֪��VOSO4������ˮ��V2O5������ˮ��NH4VO3������ˮ���ù��յ���������ͼ��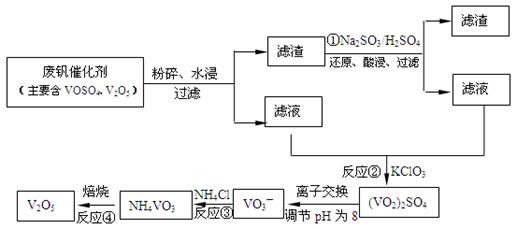
��Ӧ�٢ڢۢ�������������ԭ��Ӧ���� ����������ţ�����Ӧ�۵����ӷ���ʽΪ ���ù����з�Ӧ�۵ij����ʣ��ֳƳ����ʣ��ǻ��շ��Ĺؼ�֮һ�������ʵĸߵͳ�����ҺpHӰ���⣬����Ҫ�����Ȼ��ϵ��(NH4Cl������������Һ��V2O5��������)���¶ȡ�������ͼ�Խ�������Ȼ��ϵ�����¶ȣ� �� �� 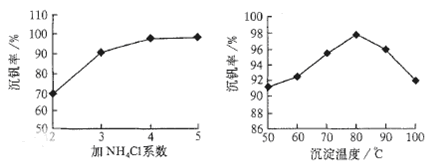
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com