
如下图所示物质间的相互转变关系,反应①在工业上可用来生产化合物C,反应⑤在工业上可生产化合物J(Na2FeO4),反应①、②、④和⑤均是在水溶液中进行的反应.常温下,D、E、G均是气体,B是无色液体;F的水溶液可作为杀菌消毒剂;H是一种铁矿石的主要成分,它由两种元素组成,且其中铁元素的质量分数为70%.
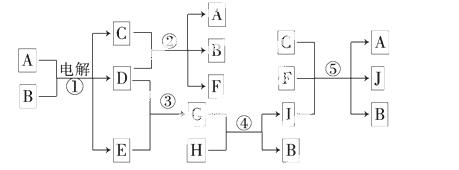
请回答下列问题:
(1)写出F的化学式:________________.
(2)写出G的电子式:________________.
(3)反应①的化学方程式为_____________________,人们将反应①涉及的化学工业称为________。
(4)反应⑤的离子方程式为______________________________________________.
高铁酸钠(Na2FeO4)被人们认为是一种“绿色环保高效”的净水剂,其原因为:
①Na2FeO4具有强氧化性可杀菌消毒;
②________________________________________________________________________
________________________________________________________________________.
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
难溶性杂卤石(K2SO4·MgSO4·2CaSO4·2H2O)属于“呆矿”,在水中存在如下平衡:
K2SO4·MgSO4·2CaSO4·2H2O(s)2Ca2++2K++Mg2++4SO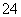 +2H2O
+2H2O
为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下:
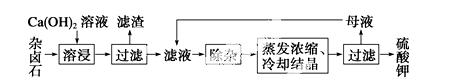
(1)滤渣主要成分有________和________以及未溶杂卤石。
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因:_________________。
(3)“除杂”环节中,先加入________溶液,经搅拌等操作后,过滤,再加入_________溶液调滤液pH至中性。
 (4)不同温度下,K+的浸出浓度与溶浸时间的关系见右图。
(4)不同温度下,K+的浸出浓度与溶浸时间的关系见右图。
由图可得,随着温度升高,
①________________,
②__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
氯离子插层镁铝水滑石[Mg2Al(OH)6Cl·xH2O]是一种新型离子交 换材料,其在高温下完全分解为MgO、Al2O3、HCl和水蒸气。现用下图装置进行实验确定其化学式(固定装置略去)。
换材料,其在高温下完全分解为MgO、Al2O3、HCl和水蒸气。现用下图装置进行实验确定其化学式(固定装置略去)。
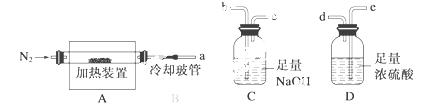
(1)Mg2Al(OH)6Cl·xH2O热分解的化学方程式为________________________________。
(2)若只通过测定装置C、D的增重来确定x,则装置的连接顺序为__________(按气流方向,用接口字母表示),其中C的作用是____________。装置连接后,首先要进行的操作的名称是____________。
(3)加热前先通N2排尽装置中的空气,称取C、D的初始质量后,再持续通入N2的作用是________、________等。
(4)完全分解后测得C增重3.65 g 、D增重9.90 g ,则x=__________。若取消冷却玻管B后进行实验,测定的x值将________(填“偏高”或“偏低”)。
(5)上述水滑石在空气中放置时易发生反应生成[Mg2Al(OH)6Cl1-2y·(CO3)y·zH2O],该生成物能发生类似的热分解反应。现以此物质为样品,用(2)中连接的装置和试剂进行实验测定 z,除测定D的增重外,至少还需测定__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
用一定量的铁与足量的稀H2SO4及足量的CuO制成单质铜,有人设计以下两种方案:①Fe H2
H2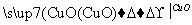 Cu ②CuO
Cu ②CuO CuSO4
CuSO4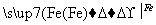 Cu
Cu
若按实验原则进行操作,则两者制得单质铜的量的比较中,正确的是 ( )
A.①多 B.②多
C.相等 D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
当氢氧化镁固体在水中达到溶解平衡Mg(OH)2(s)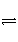
 Mg2+(aq)+2OH-(aq)时,为使Mg(OH)2固体的量减少,须加入少量的( )
Mg2+(aq)+2OH-(aq)时,为使Mg(OH)2固体的量减少,须加入少量的( )
A.MgCl2 B.NaOH C.MgSO4 D.NaHSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
难溶电解质在水溶液中存在着电离平衡。在常温下,溶液里各离子浓度以它们化学计量数为方次的乘积是一个常数,叫溶度积常数(Ksp)。例如:Cu(OH)2(s)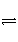
 Cu2+(aq)+2OH-,Ksp=[Cu2+]·[OH-]2=2×10-20 mol3·L-3。当溶液中各离子浓度方次的乘积大于溶度积时,则产生沉淀,反之固体溶解。
Cu2+(aq)+2OH-,Ksp=[Cu2+]·[OH-]2=2×10-20 mol3·L-3。当溶液中各离子浓度方次的乘积大于溶度积时,则产生沉淀,反之固体溶解。
(1)某CuSO4溶液里[Cu2+]=0.02 mol·L-1,如要生成Cu(OH)2沉淀,应调整溶液的pH,使之大于________。
(2)要使0.2 mol·L-1 CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液pH为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
碳元素不仅能形成丰富多彩的有机化合物,而且还能形成多种无机化合物,同时自身可以形成多种单质,碳及其化合物的用途广泛。
(1)C60分子中每个原子接2个单键和一个双键,它与F2发生加成反应,其加成产物的分子式为 ;C60的晶体结构类似于干冰,则每个C60晶胞的质量为 (用含NA的式子表示)。
(2)干冰和冰是两种常见的分子晶体,下列关于两种晶体的比较中正确的是 。
a.晶体的密度:干冰>冰 b.晶体的熔点:干冰>冰
c.晶体中的空间利用率:干冰>冰 d.晶体中分子间相互作用力类型相同
(3)金刚石和石墨是碳元素形成的两种常见单质,下列关于这两种单质的叙述中正确的有( )
a.金刚石中碳原子的杂化类型为sp3杂化,石墨中碳原子的杂化类型为sp2杂化;
b.晶体中共价键的键长:金刚石中C—C<石墨中C—C;
c.晶体的熔点:金刚石>石墨
d.晶体中共价键的键角:金刚石>石墨
e.金刚石晶体中只存在共价键,石墨晶体中则存在共价键、金属键和范德华力;
f.金刚石和石墨的熔点都很高,所以金刚石和石墨都是原子晶体
(4)立方BN结构与金刚石相似,晶胞结构如下图,在BN晶体中,B原子周围最近的N原子所构成的立体图形为 ,B原子与N原子之间共价键与配位键的数目比为 ,一个晶胞中N原子数目为 。
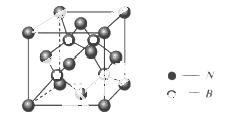
(5)碳与孔雀石共热可以得到金属铜,铜原子的原子结构示意图为 ,金属铜采用面心立方最密堆积,则Cu的晶体中Cu原子的配位数为 。已知Cu单质的晶体密度为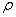 g•cm-3,Cu的相对原子质量为M,阿伏伽德罗常数NA,则Cu的原子半径为 。
g•cm-3,Cu的相对原子质量为M,阿伏伽德罗常数NA,则Cu的原子半径为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下列反应框图填空,已知反应①是工业上生产化合物D的反应,反应⑤是实验室鉴定化合物E的反应。
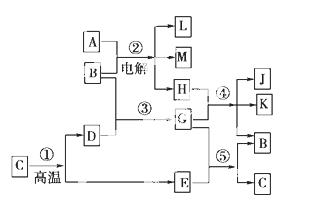
(1)单质L是______________。
(2)化合物B是______________。
(3)图中除反应①以外,还有两个用于工业生产的反应,是______________和__________(填代号)。它们的化学反应方程式分别是________和________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com