
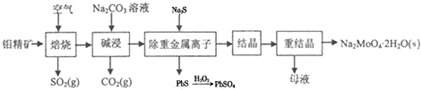
���� �����⾫��MoS2ȼ�գ���Ӧ����ʽΪ2MoS2+7O2$\frac{\underline{\;\;��\;\;}}{\;}$2MoO3+4SO2�����������£�MoO3��Na2CO3��Һ��Ӧ����Ӧ����ʽΪMoO3+CO32-=MoO42-+CO2����Ȼ������Һ�м����������ȥ�ؽ������ӣ���Һ�е�����ΪNa2MoO4������Һ����Ũ������ȴ�ᾧ��Ȼ���ؽᾧ�õ�Na2MoO4.2H2O��
��1�������ڻ��������������ϼ۴�����Ϊ����㣻
��2������ʱΪ��ʹ�⾫���ַ�Ӧ�����⾫���������Ӵ�������������������������Ӧ��Ӵ�ʱ��Խ������ӦԽ��֣�
��3�����չ������⾫��������Ҫ��Ӧ�Ļ�ѧ����ʽΪ��2MoS2+7O2$\frac{\underline{\;\;��\;\;}}{\;}$2MoO3+4SO2��Ԫ�ػ��ϼ����ߵ�ʧȥ���ӷ���������Ӧ�õ�����������ݻ�ѧ����ʽ������ϵ�������ת�����ʵ�����
��4�����������£�MoO3��Na2CO3��Һ��Ӧ���ɶ�����̼�������ƣ�
��5���������ᱵ�����ᱵ���ܶȻ������ʾ����Һ����������ӵ�Ũ�ȣ������ݼ����SO42-��ȥ���ʼ���õ��ܶȻ���
��� �⣺��1������ᾧˮ��������������Ԫ�صĻ��ϼ�ֻ����Na2MoO4����Ԫ�صĻ��ϼۼ��ɣ���Ԫ����+1����Ԫ����-2������Ԫ�صĻ��ϼ���x�������ڻ��������������ϼ۴�����Ϊ�㣬��֪�����ƣ�Na2MoO4•2H2O������Ԫ�صĻ��ϼۣ���+1����2+x+��-2����4=0����x=+6��
�ʴ�Ϊ��+6��
��2����Ӧ��Ӵ�ʱ��Խ������ӦԽ��֣����յĹ����в��á��������ա��Ĵ�ʩ�������ʯ�����ӿ���ͨ�����ȣ������⾫��������Ӵ���ʹ���ַ�Ӧ�����ԭ�ϵ������ʣ�
�ʴ�Ϊ������ʯ���飨�����ӿ����Ľ��������������ԭ���ȣ���
��3�����չ������⾫��������Ҫ��Ӧ�Ļ�ѧ����ʽΪ��2MoS2+7O2$\frac{\underline{\;\;��\;\;}}{\;}$2MoO3+4SO2��Ԫ�ػ��ϼ����ߵ�ʧȥ���ӷ���������Ӧ�õ����������Ӧ��MoԪ�ػ��ϼ�+2�۱仯Ϊ+6�ۣ���Ԫ�ػ��ϼ�-1�۱仯Ϊ+4�ۣ��÷�Ӧ������������MoO3��SO2����Ӧ������4mol�����������ת��28mol��������1mol�����������ת��Ϊ7mol��
�ʴ�Ϊ��MoO3��SO2��7��
��4�����������£�MoO3��Na2CO3��Һ��Ӧ���ɶ�����̼�������ƣ����ӷ���ʽΪMoO3+CO32-=MoO42-+CO2����
�ʴ�Ϊ��MoO3+CO32-=MoO42-+CO2����
��5����BaMoO4��ʼ����ʱ��Һ�б�����Ũ��c��Ba2+��=$\frac{Ksp��BaMn{O}_{4}��}{c��Mn{{O}_{4}}^{-}��}$=$\frac{Ksp��BaMo{O}_{4}��}{0.4mol/L}$��
��Һ�����������Ũ��c��SO42-��=$\frac{Ksp��BaS{O}_{4}��}{c��B{a}^{2+}��}$��
SO42-��ȥ����Ϊ97.5%��1-$\frac{Ksp��BaS{O}_{4}��}{c��B{a}^{2+}��}$=97.5%
1-$\frac{1.0��1{0}^{-10}}{\frac{Ksp��BaMo{O}_{4}��}{0.4mol/L}}$=97.5%
Ksp��BaMoO4��=4.0��10-8��
�ʴ�Ϊ��4.0��10-8��
���� ���⿼�����ʵ��Ʊ��Լ����ʷ�����ᴿ�ķ����ͻ��������ۺ�Ӧ�ã�Ϊ�߿��������ͣ�������ѧ���ķ���������ʵ�������ͼ��������Ŀ��飬��Ŀ��Ҫ�漰�����ᴿ�ķ������������ʵķ���Ӧ�ã��ܶȻ������ļ����֪ʶ���Ѷ��еȣ�


 Сѧ�̲�ȫ��ϵ�д�
Сѧ�̲�ȫ��ϵ�д� Сѧ��ѧ������ѿڶ���ϵ�д�
Сѧ��ѧ������ѿڶ���ϵ�д� ������Ӧ�������������ϵ�д�
������Ӧ�������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����������ױ����������ױ������� | |
| B�� | ��ȥ����ϩ������������״������� | |
| C�� | ��ȥĮ��������ˮ����Һ | |
| D�� | �Ӵֲ�Ʒ���ᴿ�������ƣ��ؽᾧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������


�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com