
【题目】常温下,向1L0.1mol·L-1NH4Cl溶液中不断加入固体NaOH后,NH4+与NH3·H2O的变化趋势如右图所示(不考虑体积变化和氨的挥发),下列说法不正确的是( )

A. M点溶液中水的电离程度比原溶液小
B. 在M点时,n(OH-)-n(H+)=(a-0.05)mol
C. 随着NaOH的加入,![]() 不断增大
不断增大
D. 当n(NaOH)=0.05mo1时,溶液中有:c(Cl-)> c(NH4+)>c(Na+)>c(OH-)>c(H+)
【答案】C
【解析】
常温下,向1L0.1mol·L-1NH4Cl溶液中不断加入固体NaOH,则溶液中发生反应NH4++OH-=NH3H2O,随着反应进行,c(NH4+)不断减小,c(NH3H2O)不断增大。
A项、M点是向1L 0.1molL-1NH4Cl溶液中,不断加入NaOH固体后,反应得到氯化铵和一水合氨的混合溶液,溶液中铵根离子浓度和一水合氨浓度相同,一水合氨是一元弱碱抑制水电离,此时水的电离程度小于原氯化铵溶液中水的电离程度,故A正确;
B项、根据电荷守恒c(H+)+c(NH4+)+c(Na+)=c(OH-)+c(Cl-),可得n(OH-)-n(H+)=[c(NH4+)+c(Na+)-c(Cl-)]×1L,在M点时c(NH4+)=0.05molL1,c(Na+)=amolL1,c(Cl-)=0.1molL1,带入数据可得n(OH-)-n(H+)=[0.05molL-1+a molL-1-0.1molL-1]×1L=(a-0.05)mol,故B正确;
C项、氨水的电离常数Kb=![]() ,则
,则![]() =
=![]() ,温度不变Kb不变,随着NaOH的加入,c(NH4+)不断减小,
,温度不变Kb不变,随着NaOH的加入,c(NH4+)不断减小,![]() 不断减小,则
不断减小,则![]() 不断减小,故C错误;
不断减小,故C错误;
D项、当n(NaOH)=0.05mol时,NH4Cl和NaOH反应后溶液中溶质为等物质的量的NH3H2O和NH4Cl、NaCl,NH3.H2O的电离程度大于NH4Cl水解程度,导致溶液呈碱性,钠离子、氯离子不水解,所以溶液中离子浓度大小顺序是c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+),故D正确。
故选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】![]() 是一种重要的化工原料,可用于合成可降解的高聚物PES树脂以及具有抗肿瘤活性的化合物K。
是一种重要的化工原料,可用于合成可降解的高聚物PES树脂以及具有抗肿瘤活性的化合物K。

已知:i. ![]()
ii. 
ⅲ.  (R1、R2、R3代表烃基)
(R1、R2、R3代表烃基)
(1) A的名称是_______________;C的官能团的名称是_______________。
(2) B分子为环状结构,核磁共振氢谱只有一组峰,B的结构简式为_______________。
(3) E分子中含有两个酯基,且为顺式结构,E的结构简式为_______________。
(4)反应①的化学方程式为_______________________。
(5)试剂a的结构简式为_______________;反应②所属的反应类型为____________反应。
(6)已知Q为G的同分异构体,同时满足下列条件Q的个数为_______(不考虑立体异构)。
①1 mol Q可与足量的NaHCO3溶液反应生成1 mol CO2
②能发生银镜反应
③苯环上有三条支链
(7)已知氨基(-NH2)与-OH类似,也能发生反应i。在由J制备K的过程中,常会产生副产物L。L分子式为C16H13NO3,含三个六元环,则L的结构简式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示一些晶体中的某些结构,请回答下列问题:

(1)代表金刚石的是(填编号字母,下同)________,其中每个碳原子与________个碳原子最近且距离相等。金刚石属于________晶体。
(2)代表石墨的是________,每个正六边形占有的碳原子数平均为________个。
(3)代表NaCl的是________,每个Na+周围与它最近且距离相等的Na+有________个。
(4)代表CsCl的是________,它属于________晶体,每个Cs+与________个Cl-紧邻。
(5)代表干冰的是________,它属于________晶体,每个CO2分子与________个CO2分子紧邻。
(6)已知石墨中碳碳键的键长比金刚石中碳碳键的键长短,则上述五种物质熔点由高到低的排列顺序为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容的容器中进行反应N2(g)+3H2(g) ![]() 2NH3(g),若氮气浓度由0.1 mol·L-1降到0.06 mol·L-1需2 s,那么由0.06 mol·L-1降到0.024 mol·L-1需要的反应时间为
2NH3(g),若氮气浓度由0.1 mol·L-1降到0.06 mol·L-1需2 s,那么由0.06 mol·L-1降到0.024 mol·L-1需要的反应时间为
A. 等于1.8 s B. 等于1.2 s C. 大于1.8 s D. 小于1.8 s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+ B2(g) = 2AB(g)的能量变化如图所示,判断下列叙述中正确的是

A.每生成2分子AB吸收bkJ热量
B.断裂1molA—A和1molB—B键,放出akJ能量
C.该反应中反应物的总能量高于生成物的总能量
D.该反应热△H=+(a-b)kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下 0.1mol/L的H2A溶液中H2A、HA-、A2-三者中所占物质的量分数(分布系数)随pH变化的关系如图所示。下列表述不正确的是

A. HA-![]() H+ + A2- K=10-4.2
H+ + A2- K=10-4.2
B. 在 0.1mol/L NaHA 溶液中,各离子浓度大小关系为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
C. 已知25℃时HF的Ka=10-3.45,将少量H2A的溶液加入足量NaF溶液中,发生的反应为:H2A+F﹣═ HF+HA﹣
D. 将等物质的量的NaHA、Na2A溶于水中,所得溶液pH恰好为4.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物X由Al2O3、Fe2O3、Cu、SiO2中的一种或几种物质组成。进行如下实验,下列有关说法正确的是( )
![]()
A.步骤I中减少的3g固体一定是混合物
B.步骤II中质量减少的物质一定是Cu
C.根据步骤I、II可以判断混合物X的成分为Al2O3、Fe2O3、Cu、SiO2
D.根据上述步骤II可以得出m(Fe2O3):m(Cu)=1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气.进行此实验,所用仪器如图:
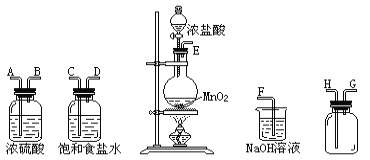
(1)连接上述仪器的正确顺序是:E接____,____接____,____接H,G接F。
(2)气体发生装置中进行的反应化学方程式是 ________;当足量的MnO2与2mol浓盐酸充分反应后(不考虑浓盐酸的挥发),得到的氯气的物质的量小于0.5mol的原因是__________。
(3)在装置中:①饱和食盐水的作用是______,②浓硫酸的作用是_____。
(4)化学实验中检验是否有Cl2产生常用_____,如果有Cl2产生,可观察到的现象是_________,写出反应方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列问题:
(1)下列各化合物中,属于同系物的是_____,属于同分异构体的是___填入编号

![]()
F.戊烯和环戊烷
(2)反—2-丁烯的结构简式_________________________;
(3)2,6–二甲基–4–乙基辛烷的结构简式:_______;1mol该有机物完全燃烧耗氧气_______________mol。
(4) CH3-CH(C2H5) – C(C2H5)=CH-CH3的系统命名的名称为___________________;
(5)某烷烃分子里含有9个碳原子,且其一氯代物只有2种,则该烷烃的系统命名的名称是______。
(6)  单体的结构简式________________。
单体的结构简式________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com