
【题目】土壤中的硝酸盐会被细菌分解。有一种脱氮硫杆菌能够利用土壤中的硫化物来分解硝酸盐,其主要化学原理如下:
5K2S+ 8KNO3 +4H2O![]() 4N2 ↑+5K2SO4 +8KOH
4N2 ↑+5K2SO4 +8KOH
还原剂是____________,还原产物是______________,
上述过程的发生改变了土壤的成分,从而对农业生产产生一定的不利影响,请选择任一角度进行简要说明:___________________________
 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
【题目】在强酸性无色透明溶液中,下列各组离子能大量共存的是( )
A.Zn2+、Al3+、SO42-、Cl-B.Ag+、Na+、NO3-、Cl-
C.Fe3+、K+、Cl-、NO3-D.Ba2+、NH4+、Cl-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】难挥发性二硫化钽(TaS2)可采用如下装置提纯。将不纯的TaS2粉末装入石英管一端,抽真空后引入适量碘并封管,置于加热炉中。反应如下:TaS2(s)+2I2(g) ![]() TaI4(g)+S2(g)下列说法正确的是
TaI4(g)+S2(g)下列说法正确的是

A. 在不同温度区域,TaI4的量保持不变
B. 在提纯过程中,I2的量不断减少
C. 在提纯过程中,I2的作用是将TaS2从高温区转移到低温区
D. 该反应的平衡常数与TaI4和S2的浓度乘积成反比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. ![]() 和
和![]() 是中子数不同质子数相同的同种核素
是中子数不同质子数相同的同种核素
B. 质子数为 53,中子数为 78 的碘原子:![]()
C. 同种元素的原子均有相同的质子数和中子数
D. 通过化学变化可以实现 16O 与 18O 间的相互转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三个密闭容器中分别充入N2、H2、O2三种气体,以下各种情况下排序正确的是( )
A. 当它们的温度和压强均相同时,三种气体的密度:ρ(H2)>ρ(N2)>ρ(O2)
B. 当它们的温度和密度都相同时,三种气体的压强:p(H2)>p(N2)>p(O2)
C. 当它们的质量和温度、压强均相同时,三种气体的体积:V(O2)>V(N2)>V(H2)
D. 当它们的压强和体积、温度均相同时,三种气体的质量:m(H2)>m(N2)>m(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铁,黑棕色结晶,熔点306℃、沸点315℃,易升华;FeCl3易溶于水且具有强烈的吸水性。某化学兴趣小组利用如下装置(夹持仪器略去)制备氯化铁晶体 ( FeCl3.6H2O)。
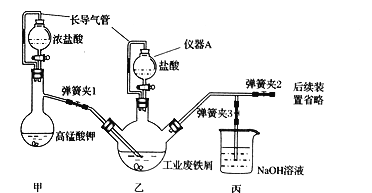
(1)仪器A的名称是 ____,在该实验中长导气管的作用是____,同时防止盐酸挥发污染环境。
(2)装置甲中发生反应的离子方程式为 ____,装置丙的作用为__________________ 。
(3)为顺利达成实验目的,实验过程中先关闭弹簧夹l和3,打开弹簧夹2,再打开乙装置中的活塞,待铁粉完全溶解后,关闭乙中的活塞,___ 再打开甲中的活塞。
(4)在实验过程中判断乙瓶中铁元素完全转化成氯化铁的方法是:取试样于试管中,然后向试管中力口入 __(填试剂)后观察现象。
(5)反应结束后,将乙中溶液边加入____,边进行加热浓缩、____、过滤、洗涤、干燥即得到产品。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中通常含有NO和CO等大气污染物,科学家寻找高效催化剂实现了汽车尾气的转化,进而减少汽车尾气对大气的污染。
(1)在100 kPa和298.15 K下,由稳定单质生成1 mol化合物的焓变称为该物质在 298.15 K时的标准摩尔生成焓。已知NO标准摩尔生成焓AH= +91.5 kJ/moI,CO的标准燃烧热AH=- 283kJ/mol,由此写出NO和CO反应的热化学反应方程式____。
(2) 一定温度下,向2L恒容密闭容器中充入4.0molNO2和4.0molCO,在催化剂作用下发生反应4CO(g)+2NO2(g) = N2(g)+4CO2(g) △H<0,测得相关数据如下:

①5~l0min,用NO2的浓度变化表示的反应速率为____。
②以下表述能说明该反应己达到平衡状态的是____。
A.气体颜色不再变化
B.气体密度不再变化
C.气体平均相对分子质量不再变化
③20 min时,保持温度不变,继续向该容器中加入l.0mol NO2和l.0molCO,在t1时反应再次达到平衡,则N02的转化率比原平衡____(填“增大”、“减小”或“不变)。
④该温度下反应的化学平衡常数K= _____(保留两位有效数字)。
(____) N2O4与NO2之间存在反应N2O4(g) ![]() 2NO2(g )。将一定量的N2O4放入恒容密闭容器中,在一定条件下,该反应N2O4、NO2的消耗速率与自身压强间存在关系:v(N2O4)=klp(N2O4),v(NO2)=k2P2(NO2),其中k1、k2是与反应温度有关的常数。则一定温度下,k1、k2与平衡常数Kp的关系是k1=_____。(Kp为平衡分压代替平衡浓度计算所得的平衡常数,分压=总压×物质的量分数)
2NO2(g )。将一定量的N2O4放入恒容密闭容器中,在一定条件下,该反应N2O4、NO2的消耗速率与自身压强间存在关系:v(N2O4)=klp(N2O4),v(NO2)=k2P2(NO2),其中k1、k2是与反应温度有关的常数。则一定温度下,k1、k2与平衡常数Kp的关系是k1=_____。(Kp为平衡分压代替平衡浓度计算所得的平衡常数,分压=总压×物质的量分数)
(4)电解法处理氮氧化合物是目前大气污染治理的一个新思路,原理是将NOx在电解池中分解成无污染的N2除去,如图示,两电极间是固体氧化物电解质,在一定条件下可自由传导 O2-,如果NOx为NO,则电解池阴极电极反应式为______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体氧化物燃料电池(SOFC)以固体氧化物作为电解质,其工作原理如图所示。下列关于固体燃料电池的有关说法中正确的是( )

A. 固体氧化物的作用是让电子在电池内通过
B. 固体氧化物中O2﹣从a极向b极移动
C. 电极b为电池的负极,电极反应式为:O2+4e﹣=2O2﹣
D. 若以C3H8为燃料气,则接触面上发生的反应为C3H8﹣20e﹣+10O2﹣═3CO2+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用上面的电池对下物质进行电解,其中a、b、c、d、e、f电极均为惰性电极,通电后,a极产生的气体明显多于b极,2分钟后,测得乙池的pH为12,则

(1)电源A极是____极.
(2)2分钟后,若将乙池恢复到电解前的状态,则应加入______,加入的物质的量为______mol。
(3)丙池中发生反应的离子方程式为:________________
(4)丙装置上某极可析出固体___克,溶液的n(H+)为_____.
(5)电解n分钟后,硫酸铜正好消耗完,再将e、f电极反接电源,用同样的电流再电解n分钟,则丙溶液中的硫酸铜的物质的量浓度为______mol/L.(不考虑溶液体积变化)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com