
分析 (1)结合热化学方程式书写方法,标注物质聚集状态和对应焓变;
(2)水煤气中主要成分是CO和H2,二者的体积比为l:l,l mol CH4气体完全燃烧生成CO2气体和气态水放出802kJ热量,结合热化学方程式计算热量之比.
解答 解:(1)1mol H2完全燃烧生成气态水放出242kJ热量,所以H2完全燃烧生成气态水的热化学方程式:H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-242kJ•mol-1,
故答案为:H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-242kJ/mol;
(2)依据热化学方程式:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-242kJ•mol-1;
CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802kJ/mol;
CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283KJ/mol;
水煤气中主要成分是CO和H2,二者的体积比为l:l,1molCH4燃烧放热802kJ,1molCO、H2混合气体放热$\frac{283+242}{2}$kJ=262.5kJ,相同状况下若得到相等的热量,所需水煤气与甲烷的体积比约为$\frac{Q}{262.5}$:$\frac{Q}{802}$=3.06:1,所需水煤气体积是甲烷体积的3.06倍,燃烧生成的CO2的体积比等于其物质的量之比$\frac{3.06×\frac{1}{2}}{1}$=1.5:1,水煤气放出CO2的体积是甲烷放出CO2的体积的1.5倍,
故答案为:3.06,1.5.
点评 本题主要考查了热化学方程式书写,反应热量的计算应用,燃烧特征的比较分析,注意反应中的热量与物质的量成正比,题目难度中等.


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案科目:高中化学 来源: 题型:选择题
| A. | C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g);△H=-1367.0 kJ/mol(燃烧热) | |
| B. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=+57.3 kJ/mol(中和热) | |
| C. | S(s)+O2(g)═SO2(g);△H=-296.8 kJ/mol(反应热) | |
| D. | 2NO2═O2+2NO;△H=116.2 kJ/mol(反应热) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (CH3)3COH的名称:2,2二甲基乙醇 | B. | 乙醛的结构式:CH3CHO | ||
| C. | CH4分子的比例模型: | D. | 丙烯分子的结构简式为 CH3CHCH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)=2H2O(l)△H1; 2H2(g)+O2(g)=2H2O(g)△H2 | |
| B. | S(g)+O2(g)=SO2(g)△H1; S(s)+O2(g)=SO2(g)△H2 | |
| C. | C(s)+$\frac{1}{2}$O2(g)=CO(g)△H1; C(s)+O2(g)=CO2(g)△H2 | |
| D. | H2(g)+Cl2(g)=2HCl(g)△H1; $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)=HCl(g)△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,蓄电池内电路中H+向负极移动 | |
| B. | 放电时,每通过lmol电子,蓄电池就要消耗2molH2SO4 | |
| C. | 充电时,阳极反应:PbSO4+2e-→Pb+SO42- | |
| D. | 充电时,铅蓄电池的负极与外接电源的负极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铍原子的半径小于硼原子的半径 | |
| B. | 相同条件下,单质铍与酸反应比单质锂与酸反应剧烈 | |
| C. | 氢氧化铍的碱性比氢氧化钙的碱性弱 | |
| D. | 单质铍能与冷水剧烈反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
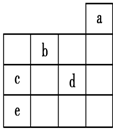
| A. | 元素b位于VIA族,有+6、-2两种常见化合价 | |
| B. | 元素的最高价氧化物对应的水化物的酸性:d>c>e | |
| C. | 金属性c>e | |
| D. | 元素的气态氢化物的稳定性:e>c>d |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com