
| 实验装置 |  |
 |
 |
 |
| 部分实验现象 | a极质量减小 b极质量增加 |
b极有气体产生 c极无变化 |
d极溶解 c极有气体产生 |
电流计指示在导线中 电流从a极流向d极 |
| A、a>b>c>d |
| B、b>c>d>a |
| C、d>a>b>c |
| D、a>b>d>c |
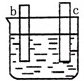 中发生化学腐蚀,活泼金属与酸反应放出氢气,不活泼金属与酸不反应;
中发生化学腐蚀,活泼金属与酸反应放出氢气,不活泼金属与酸不反应;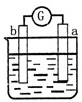 、
、 、
、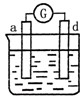 中发生电化学腐蚀,活泼金属作负极,不活泼金属作正极,负极发生氧化反应,正极发生还原反应,电子从负极经外电路流向正极,电流和电子分析相反,据此来回答判断.
中发生电化学腐蚀,活泼金属作负极,不活泼金属作正极,负极发生氧化反应,正极发生还原反应,电子从负极经外电路流向正极,电流和电子分析相反,据此来回答判断. 中发生化学腐蚀,b极有气体产生,c极无变化,所以金属的活动性顺序b>c;
中发生化学腐蚀,b极有气体产生,c极无变化,所以金属的活动性顺序b>c; 中发生电化学腐蚀,a极质量减小,b极质量增加,a极为负极,b极为正极,所以金属的活动性顺序a>b;
中发生电化学腐蚀,a极质量减小,b极质量增加,a极为负极,b极为正极,所以金属的活动性顺序a>b; 中发生电化学腐蚀,电流从a极流向d极,a极为正极,d极为负极,所以金属的活动性顺序d>a;
中发生电化学腐蚀,电流从a极流向d极,a极为正极,d极为负极,所以金属的活动性顺序d>a; 中发生电化学腐蚀,d极溶解,所以d是负极,c极有气体产生,所以c是正极,所以金属的活动性顺序d>c;
中发生电化学腐蚀,d极溶解,所以d是负极,c极有气体产生,所以c是正极,所以金属的活动性顺序d>c;

科目:高中化学 来源: 题型:
 如图是某学校实验室从化学试剂商店买回来的氢氧化钠试剂标签上的部分内容.某同学从该试剂瓶中取出20.0g固体,配成1L溶液,请计算:
如图是某学校实验室从化学试剂商店买回来的氢氧化钠试剂标签上的部分内容.某同学从该试剂瓶中取出20.0g固体,配成1L溶液,请计算:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电离平衡常数(K)越小,表示弱电解质电离能力越弱 |
| B、电离平衡常数(K)与温度无关 |
| C、不同浓度的同一弱电解质,其电离平衡常数(K)不同 |
| D、多元弱酸各步电离平衡常数相互关系为:K1<K2<K3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ba(OH)2溶液与稀硫酸反应:Ba2++OH-+H++SO42-═BaSO4↓+H20 |
| B、Fe与FeCl3溶液反应:Fe+Fe3+═2Fe2+ |
| C、大理石中加入稀盐酸:CaCO3+2H+═Ca2++CO2↑+H2O |
| D、AlCl3溶液中加过量氨水:Al3++3OH-═Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||||
| B、OH-个数将减少 | ||||
| C、NH4+浓度将减小 | ||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CaO+H2O═Ca(OH)2,可以放出大量的热,故可把该反应设计成原电池,把其中的化学能转化为电能 |
| B、某原电池反应为Cu+2AgNO3═Cu(NO3)2+2Ag,装置中的盐桥中可以是由KCl饱和溶液制得的琼脂 |
| C、因为铁的活动性强于铜,所以将铁、铜用导线连接后放入浓硝酸中,若能组成原电池,必是铁作负极,铜作正极 |
| D、理论上说,任何能自发进行的氧化还原反应都可被设计成原电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 除去混有的杂质气体 |
B、 浓硫酸稀释 |
C、 分离出AgNO3溶液中AgCl |
D、 称量30.46g的NaOH固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO3溶于水能导电,但SO3是非电解质 |
| B、酸、碱、盐是电解质,都有很强的导电能力 |
| C、电解质在水中一定能导电,在水中导电的化合物一定是电解质 |
| D、纯水的导电性很差,所以水不是电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com