
分析 A、B两种互溶的化合物不溶于水且密度比水小,常温下A为液体,B为固体,A不与NaOH反应,B与NaOH作用生成水和可溶的C,C与盐酸作用可得NaCl和B,则B可能为羧酸或酚,
(1)采用萃取的方法加以分离,混合物加NaOH,A在上层,提取并分离出B时在下层溶液中加盐酸后,B在上层;
(2)采用蒸馏的方法加以分离,需要铁架台(附有铁圈、铁夹、石棉网)、蒸馏烧瓶、酒精灯、接液管、冷凝管、牛角管、锥形瓶等,沸点低的先蒸馏出来.
解答 解:A、B两种互溶的化合物不溶于水且密度比水小,常温下A为液体,B为固体,A不与NaOH反应,B与NaOH作用生成水和可溶的C,C与盐酸作用可得NaCl和B,则B可能为羧酸或酚,
(1)采用萃取的方法加以分离,混合物加NaOH,A在上层,实验操作的正确顺序是②向分液漏斗中加入A和B的混合物、③向分液漏斗中加入NaOH溶液、④充分振荡混合液,静置、分液,从上层分离出A;提取并分离出B时在下层溶液中加盐酸后,B在上层,提取并分离出B的操作顺序是⑤将烧杯中的液体重新倒回分液漏斗中、①向分液漏斗中加入稀盐酸、④充分振荡混合液,静置、分液,从上层分离出B,
故答案为:②③④;上;⑤①④;上;
(2)采用蒸馏的方法加以分离,需要铁架台(附有铁圈、铁夹、石棉网)、蒸馏烧瓶、酒精灯、接液管、冷凝管、牛角管、锥形瓶等,沸点低的先蒸馏出来,则A先蒸馏出,
故答案为:冷凝管;牛角管;锥形瓶;A.
点评 本题考查混合物分离实验方案的设计,为高频考点,把握两物质不溶于水、密度比水的小的性质及分液、蒸馏原理为解答的关键,侧重分析与实验能力的考查,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将pH=4的CH3COOH溶液加水稀释10倍,溶液中各离子浓度均减小 | |
| B. | 用CH3COOH溶液滴定等物质的量浓度NaOH溶液至pH=7,V(CH3COOH)<V(NaOH)溶液 | |
| C. | 向0.2mol/L的盐酸溶液中加入等体积0.1mol•L-1的NH3•H2O溶液:c(Cl-)+c(OH-)=c(H+)+c(NH3•H2O) | |
| D. | 在含0.1mol NaHSO4溶液中:c(H+)=c(SO42-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
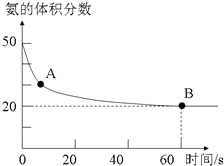 氨气是一种重要的化工原料,在工农业中都有广泛的应用.
氨气是一种重要的化工原料,在工农业中都有广泛的应用.| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度 (10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  表示稀释冰醋酸过程中溶液导电性的变化曲线 | |
| B. |  曲线表示反应2SO2(g)+O2(g)═2SO3(g);△H<0 正、逆反应的平衡常数K随温度的变化 | |
| C. | 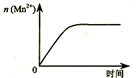 表示10 mL 0.01 mol•L-1 KMnO4 酸性溶液与过量的0.1 mol•L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化 | |
| D. | 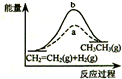 a、b曲线分别表示反应CH2=CH2 (g)+H2(g)→CH3CH3(g);△H<0使用和未使用催化剂时,反应过程中的能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
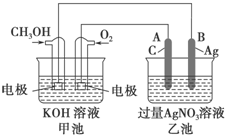 如图是一个化学过程的示意图.已知甲池的总反应式为2CH3OH+3O2+4KOH═2K2CO3+6H2O
如图是一个化学过程的示意图.已知甲池的总反应式为2CH3OH+3O2+4KOH═2K2CO3+6H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MnO4-、Fe2+、K+、Cl- | B. | Ca2+、Na+、Cl-、SO42- | ||
| C. | Ca2+、Cl-、NO3-、K+ | D. | Ca2+、H+、OH-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
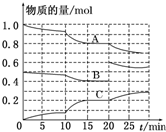 在恒定温度T℃,2L恒容密闭容器中发生反应aA(g)+bB(g)?cC(g),容器中A、B、C物质的量变化如图所示,回答下列问题:
在恒定温度T℃,2L恒容密闭容器中发生反应aA(g)+bB(g)?cC(g),容器中A、B、C物质的量变化如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锗是一种金属性很强的元素 | B. | 锗化氢(GeH4)稳定性很强 | ||
| C. | 锗酸(H4GeO4)是难溶于水的强酸 | D. | 锗元素位于第四周期第ⅣA族 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com