
分析 (1)0.56L气体的物质的量为:$\frac{0.56L}{22.4L/mol}$=0.025mol,根据M=$\frac{m}{n}$进行计算求解;
(2)平均相对分子质量为1.25×22.4=28,设CO2与CH4的物质的量分别为xmol和ymol则$\frac{44x+16y}{x+y}=28$,由此分析解答;
(3)根据结晶水的化合物受热分解的化学方程式及其相关数据可以计算n的表达式;
(4)根据n=$\frac{V}{{V}_{m}}$计算HCl的物质的量,根据m=nM计算HCl质量,根据m=dV计算水的质量,溶液质量=水的质量+HCl的质量,根据V=$\frac{m}{d}$计算溶液体积,再根据c=$\frac{n}{V}$计算盐酸的物质的量浓度.
解答 解:(1)0.56L气体的物质的量为:$\frac{0.56L}{22.4L/mol}$=0.025mol,M=$\frac{m}{n}$=$\frac{1.1g}{0.025mol}$=44 g•mol-1,故答案为:44 g•mol-1;
(2)平均相对分子质量为1.25×22.4=28,设CO2与CH4的物质的量分别为xmol和ymol则$\frac{44x+16y}{x+y}=28$,解之得x=$\frac{3}{4}y$,所以CO2的体积分数为$\frac{x}{x+y}$=$\frac{3}{7}$或42.86%,该混合气体对氢气的相对密度为$\frac{28}{2}$=14.0,故答案为:$\frac{3}{7}$;14.0;
(3)A•n H2O受热分解的化学方程式为:A•nH2O$\frac{\underline{\;\;△\;\;}}{\;}$A+nH2O,根据提供的数据有:
A•nH2O$\frac{\underline{\;\;△\;\;}}{\;}$A+nH2O,
M+18n M
ag bg
$\frac{M+18n}{M}$=$\frac{ag}{bg}$,
n=$\frac{(a-b)M}{18b}$,故答案为:$\frac{(a-b)M}{18b}$;
(4)标况下,aL HCl的物质的量为$\frac{aL}{22.4L/mol}$=$\frac{a}{22.4}$mol,
HCl质量为$\frac{a}{22.4}$mol×36.5g/mol=$\frac{36.5a}{22.4}$g,水的质量为1000mL×1g/mL=1000g,溶液质量=(1000+$\frac{36.5a}{22.4}$)g,溶液体积=$\frac{(1000+\frac{36.5a}{22.4})g}{1000dg/L}$=$\frac{22400+36.5a}{22400d}$L,该盐酸的物质的量浓度为$\frac{\frac{a}{22.4}mol}{\frac{22400+36.5a}{22400d}L}$=$\frac{1000ab}{22400+36.5a}$mol/L,故答案为:$\frac{1000ab}{22400+36.5a}$.
点评 本题考查物质的量浓度计算,注意对定义式的理解掌握,关键是计算溶液体积,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
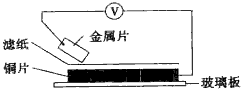 将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如表
将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如表 | 金属 | 电子流动方向 | 电压 |
| 甲 | 甲→Cu | +0.78 |
| 乙 | Cu→乙 | +0.15 |
| 丙 | 丙→Cu | +1.35 |
| 丁 | 丁→Cu | +0.30 |
| A. | 在四种金属中乙的还原性最强 | |
| B. | 金属乙能从硫酸铜溶液中置换出铜 | |
| C. | 甲、丁若形成原电池时,甲为负极 | |
| D. | 甲、乙形成合金在空气中,乙先被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
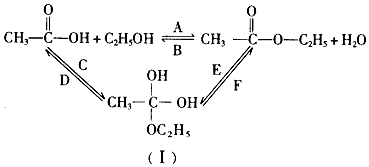
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液的pH不可能是7 | B. | 该溶液的pH一定是4 | ||
| C. | 该溶液的pH一定是10 | D. | 不会有这样的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
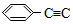 -CH=CH-CH3,有关其结构说法正确的是( )
-CH=CH-CH3,有关其结构说法正确的是( )| A. | 所有原子可能在同一平面上 | B. | 侧链所有碳原子可能共直线 | ||
| C. | 所有碳原子可能共面 | D. | 最多有18原子共面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、NO、CO、烟尘 | B. | CO2、Cl2、N2、雾 | C. | HCl、NO2、N2、粉尘 | D. | CO2、NO、NH3、H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,2molSO2 和 1molO2 混合在密闭容器中充分反应后容器中的分子数大于2NA | |
| B. | 256g S8 分子中含 S-S 键为 7NA 个 | |
| C. | 由 1molCH3COONa 和少量 CH3COOH 形成的中性溶液中,CH3COO-数目为 NA 个 | |
| D. | 1 mol Na 与 O2 完全反应,生成 NaO2 和 Na2O2的混合物,转移电子总数为 NA 个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | C-H | C-O | O-H | C=O | O=O | C-C |
| 键能(kJ•mol-1) | 414 | 326 | 464 | 728 | 498 | 332 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com