
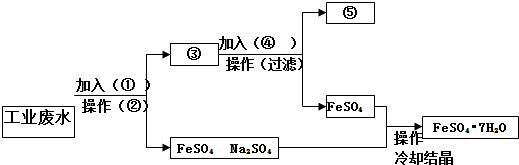
分析 工业废水中含大量硫酸亚铁、Cu2+和少量的Na+,先向混合液中加入过量Fe,然后过滤,则滤液中主要含硫酸亚铁、硫酸钠,再通过浓缩、蒸发结晶可以分离出硫酸亚铁;滤渣为Cu、Fe,向滤渣中加入H2SO4,通过过滤后可以分离出金属铜,以此解答该题.
解答 解:工业废水中含大量硫酸亚铁、Cu2+和少量的Na+,从该废水中回收硫酸亚铁和金属铜,结合流程可知,①为Fe,操作②为过滤,③中含Cu、Fe,加入④为H2SO4,过滤,得到⑤为Cu,硫酸亚铁溶液经蒸发、浓缩、结晶、过滤,可得到FeSO4.7H2O,
故答案为:①铁粉; ②过滤; ③铁、铜;④硫酸;⑤铜.
点评 本题考查混合物分离提纯实验方案的设计,为高频考点,题目难度中等,把握实验流程中的试剂及发生的反应、混合物分离方法为解答的关键,侧重分析与推断能力的考查.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
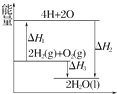
| A. | △H<0 | B. | △H2为该反应的反应热 | ||
| C. | △H3不是H2的燃烧热 | D. | △H3=△H1+△H3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素丙的单质可用于冶炼金属 | |
| B. | 甲的氢化物比丁的氢化物热稳定性强 | |
| C. | 简单离子半径:乙>丁>丙 | |
| D. | 甲与乙的氧化物均有强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
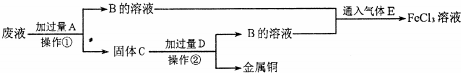
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L | B. | 0.15mol/L | C. | 0.2mol/L | D. | 0.25mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
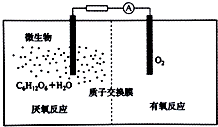 氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
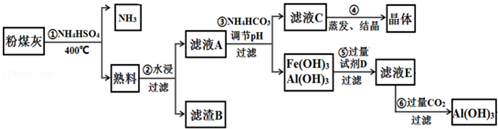
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Co2O3 | B. | Co3O3 | C. | Co3O4 | D. | Co5O7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com