
| A. | H2SO4 | B. | NaNO3 | C. | KOH | D. | MgO |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
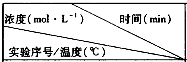 | 0 | 10 | 20 | 30 | 40 | 50 |
| 实验1/800 | 1.00 | 0.80 | 0.65 | 0.55 | 0.50 | 0.50 |
| 实验2/800 | 1.00 | 0.70 | 0.50 | 0.50 | 0.50 | 0.50 |
| 实验3/850 | 1.00 | 0.50 | 0.40 | 0.15 | 0.15 | 0.15 |
| A. | 实验2比实验1的反应容器内压强减小 | |
| B. | 实验2比实验l使用了效率更高的催化剂 | |
| C. | 实验1比实验3的平衡常数大 | |
| D. | 实验2和实验3可判断该反应是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中一定不含共价键,共价化合物中一定不含离子键 | |
| B. | 两种微粒,若核外电子排布完全相同,则其化学性质一定相同 | |
| C. | 碳原子之间可形成碳碳单键、碳碳双键或碳碳叁键 | |
| D. | 分子间作用力越大,分子的热稳定性就越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
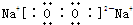 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com