
【题目】海水资源的开发和利用是当前科学研究的一项重要任务。下图是实验室模拟镁开发的流程图:
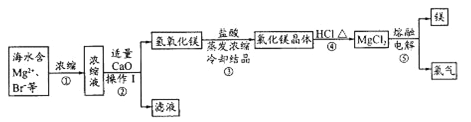
根据上述流程图,回答下列问题:
(1)操作I的名称是________。
(2)步骤中②反应的化学方程式为________。
(3)步骤④中加热时通入HCl气流的作用是__________。
(4)步骤⑤的离子反应方程式为___________。
(5)有人提出步骤⑤的副产物可在流程中再利用以提高海水的综合利用率。若A为上述流程中的某组分,则A、B分别为_____________。
【答案】过滤 CaO+H2O=Ca(OH)2 MgBr2+ Ca(OH)2= Mg(OH)2↓+CaBr2(MgBr2也可是MgCl2、MgSO4等) 增大HCl浓度抑制MgCl2的水解 Mg2++2Cl-![]() Mg+Cl2↑ 滤液(或浓缩液) Br2
Mg+Cl2↑ 滤液(或浓缩液) Br2
【解析】
海水中主要有Na+,Cl-,Mg2+,Br-,SO42-等离子,蒸发浓缩后取浓缩液加CaO后会产生Mg(OH)2沉淀,进行过滤,滤液中当然含有Na+,Cl-,Br-,SO42-等离子。取所得的Mg(OH)2加HCl后进行浓缩结晶得到MgCl2晶体。再在HCl氛围中加热使其失去结晶水,得到MgCl2后,再进行电解得到Mg和Cl2。
(1)将固体和液体分开采用过滤。
(2)步骤中②反应的化学方程式为CaO+H2O=Ca(OH)2 MgBr2+ Ca(OH)2= Mg(OH)2↓+CaBr2。
(3)步骤④中加热时通入HCl增大HCl浓度,在HCl氛围中,抑制MgCl2的水解,不能直接加热,否则MgCl2晶体会发生水解得到Mg(OH)2。
(4)步骤⑤的离子反应方程式为Mg2++2Cl-![]() Mg+Cl2↑,在熔融状态下MgCl2会电离出离子,所以要拆成离子形式。
Mg+Cl2↑,在熔融状态下MgCl2会电离出离子,所以要拆成离子形式。
(5)上述流程中除了Mg,还能与Cl2反应的只有Br-,存在于溶液中,通过Cl2置换,可以回收利用Br2。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】高血脂严重影响人体健康,化合物E是一种临床治疗高血脂症的药物。E的合成路线如下(部分反应条件和试剂略):

已知: +CO2↑(R1和R2代表烷基)
+CO2↑(R1和R2代表烷基)
请回答下列问题:
(1)试剂Ⅰ的名称是________,试剂Ⅱ中官能团的名称是________,第②步的反应类型是_____。
(2)第①步反应的化学方程式是__________________________。
(3)第⑥步反应的化学方程式是__________________________。
(4)第⑦步反应中,试剂Ⅲ为单碘代烷烃,其结构简式是_____________。
(5)C的同分异构体在酸性条件下水解,生成X、Y和CH3(CH2)4OH。若X含有羧基和苯环,且X和Y的核磁共振氢谱都只有两种类型的吸收峰,则X与Y发生缩聚反应所得缩聚物的结构简式是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】300℃时,将2mol A和2mol B两种气体混合加入2L密闭容器中,发生反应3A(g)+B(g)![]() 2C(g)+2D(g)△H,2min末反应达到平衡,生成0.8mol D。(用三段式解答。)
2C(g)+2D(g)△H,2min末反应达到平衡,生成0.8mol D。(用三段式解答。)
(1)求该反应的平衡常数____。
(2)求平衡时A的转化率____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,某容积为2L的密闭容器内,某一反应中M、N(均为气体)的物质的量随反应时间变化的曲线如图,如图所示:

(1)该反应的化学方程式是__________。
(2)在图上所示的三个时刻中,_____(填t1、t2或t3)时刻处于平衡状态,t2时刻V(生成M)____V(消耗M)(填>、<或=);
(3)若反应容器的容积不变,则“压强不再改变”_______(填“能”或“不能”)作为该反应已达到平衡状态的判断依据。
(4)下列措施能增大反应速率的是_____(选填字母)。
A.升高温度 B.降低压强 C.减小M的浓度 D.将反应容器体积缩小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,下列叙述正确的是![]()
A.![]() 的
的![]() 与
与![]() 混合溶液中
混合溶液中![]()
B.![]() 的可乐中
的可乐中![]() 是
是![]() 的柠檬水中
的柠檬水中![]() 的10倍
的10倍
C.AgCl在![]()
![]() 溶液和
溶液和![]() NaCl溶液中的溶解度相同
NaCl溶液中的溶解度相同
D.![]() 溶液加水稀释至100mL,pH和
溶液加水稀释至100mL,pH和![]() 均减小
均减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胆矾是一种常见的化合物,工业上它也是一种制取其它含铜化合物的原料,现有废铜(主要杂质为Fe)来制备胆矾。有人设计了如下流程:
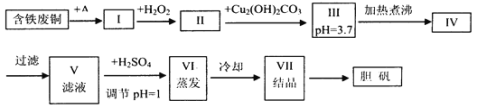
pH值控制可参考下列数据
物质 | 开始沉淀时的pH值 | 完全沉淀时的pH值 |
氢氧化铁 | 2.7 | 3.7 |
氢氧化亚铁 | 7.6 | 9.6 |
氢氧化铜 | 5.2 | 6.4 |
请根据上述流程回答下列问题:
(1)A可选用__(填字母)
a.稀H2SO4 b.浓H2SO4、加热 c.浓FeCl3溶液 d.浓HNO3
(2)Ⅰ中加H2O2的目的__。
(3)Ⅱ中加Cu2(OH)2CO3的目的是__,其优点是__。
(4)Ⅲ加热煮沸时发生的化学反应的离子方程式为__。
(5)V中加H2SO4调节pH=1是为了__。
查看答案和解析>>
科目:高中化学 来源: 题型:
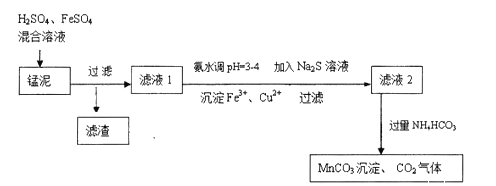
【题目】用软锰矿![]() 主要成分为
主要成分为![]() 生产高锰酸钾产生的锰泥中,还含有
生产高锰酸钾产生的锰泥中,还含有![]() 的
的![]() 、
、![]() 的
的![]() 均为质量分数
均为质量分数![]() ,及少量Cu、Pb的化合物等,用锰泥可回收制取
,及少量Cu、Pb的化合物等,用锰泥可回收制取![]() ,过程如图:
,过程如图:
![]() 高锰酸钾的氧化性强弱与溶液的酸碱性有关,在酸性条件下其氧化性较强,通常用来酸化高锰酸钾的酸是 ______ .
高锰酸钾的氧化性强弱与溶液的酸碱性有关,在酸性条件下其氧化性较强,通常用来酸化高锰酸钾的酸是 ______ .
![]() 除去滤液1中
除去滤液1中![]() 的离子方程式是 ______ .
的离子方程式是 ______ .
![]() 经实验证明:
经实验证明:![]() 稍过量时,起始
稍过量时,起始![]() 、
、![]() 混合溶液中
混合溶液中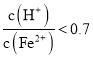 时,滤液1中能够检验出有
时,滤液1中能够检验出有![]() ;
;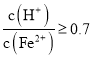 时,滤液1中不能检验出有
时,滤液1中不能检验出有![]() 根据上述信息回答①②③:
根据上述信息回答①②③:
①检验![]() 是否氧化完全的实验操作是 ______ .
是否氧化完全的实验操作是 ______ .
②生产时![]() 、
、![]() 混合溶液中
混合溶液中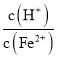 应控制在
应控制在![]() 之间,不宜过大,请结合后续操作从节约药品的角度分析,原因是 ______ .
之间,不宜过大,请结合后续操作从节约药品的角度分析,原因是 ______ .
③若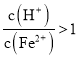 ,调节
,调节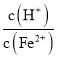 到
到![]() 的最理想试剂是 ______
的最理想试剂是 ______ ![]() 填序号
填序号![]()
![]() 溶液
溶液 ![]() 铁粉
铁粉 ![]()
![]() 写出滤液2中加入过量
写出滤液2中加入过量![]() 反应的离子方程式: ______ .
反应的离子方程式: ______ .
![]() 上述过程锰回收率可达
上述过程锰回收率可达![]() ,若处理1740kg的锰泥,可生产
,若处理1740kg的锰泥,可生产![]() ______ kg.
______ kg.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在固定容积的密闭容器中,可逆反应2X +Y(g)![]() Z(s)已达到平衡,此时升高温度则气体混合物的密度增大。下列叙述正确的是( )
Z(s)已达到平衡,此时升高温度则气体混合物的密度增大。下列叙述正确的是( )
A.若X为非气态,则正反应为吸热反应
B.正反应为放热反应,X一定为气态
C.正反应为放热反应,X可能是气态、液态或固态
D.若加入少量的Z,该平衡向左移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B、C、D四种物质混合,发生如下反应:aA+bB![]() cC(s)+dD,当反应进行一定时间后,测得A减少了nmol,B减少了
cC(s)+dD,当反应进行一定时间后,测得A减少了nmol,B减少了![]() n mol,C增加了
n mol,C增加了![]() n mol,D增加了n mol,此时达到化学平衡。请填写下列空白:
n mol,D增加了n mol,此时达到化学平衡。请填写下列空白:
(1)该化学方程式各物质的化学计量数为a=_____、b=______、c=_____、d=______。
(2)若只改变压强,反应速率发生变化,但平衡不发生移动,该反应中物质D的聚集状态为______。
(3)若只升高温度,反应一段时间后,测知四种物质其物质的量又达到相等,则该反应为________反应(填“放热”或“吸热”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com