
科目:高中化学 来源: 题型:
| T/K | T1 | T2 | T3 |
| K | 1.00×107 | 2.54×105 | 1.88×103 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 为证明有关物质的性质,某学生设计了如图所示的装置.当打开活塞C,使液体A与隔板H上的固体B相遇时,即有气体产生,并发现D中蜡烛熄灭;关闭C 打开E时,则看到G中蜡烛燃得更亮,且F中盛放固体为淡黄色.
为证明有关物质的性质,某学生设计了如图所示的装置.当打开活塞C,使液体A与隔板H上的固体B相遇时,即有气体产生,并发现D中蜡烛熄灭;关闭C 打开E时,则看到G中蜡烛燃得更亮,且F中盛放固体为淡黄色.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
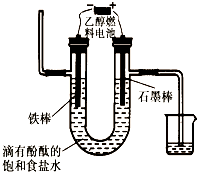 据报道,一定条件下由二氧化碳和氢气合成乙醇已成为现实.
据报道,一定条件下由二氧化碳和氢气合成乙醇已成为现实.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等物质的量浓度的下列溶液中,①NH4Al(SO4)2②NH4Cl③CH3COONH4④NH3?H2O,c(NH4+)由大到小的顺序是:②>①>④>③ |
| B、室温下,向0.01mol?L-1NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
| C、向0.2mol?L-1NaHCO3溶液中加如等体积0.1mol?L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| D、对于反应N2H4(l)=N2(g)+2H2(g)△H=-50.6kJ?mol-1在任何温度下都能自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol?L-1的K2SO4溶液中有2NA个K+ |
| B、1mol Cl2与足量铁反应,转移2NA个电子 |
| C、标准状况下,22.4L氨气溶于水,此溶液中含有NA个NH3分子 |
| D、所含溶质为63g的浓硝酸与足量的铜反应,生成的气体分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若C2H6分子中含共价键数为7NA,则乙烷的体积为22.4L |
| B、58.5g氯化钠固体中含NaCl分子数为NA |
| C、78g液态笨分子中含碳碳双键数目为3NA |
| D、28g N2和6g H2在高温高压铁触媒催化作用下,生成的NH3分子数一定小于2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com