
【题目】某温度时,使用一对石墨电极电解饱和Na2SO4溶液,当转移2 mol电子时停止电解,析出Na2SO4·10H2O晶体m g,所有数据都在相同温度下测得,下列叙述不正确的是
A. 电解后溶液质量减少(m+18)g
B. 原溶液中Na2SO4的质量分数为![]()
C. 若其他条件不变,将石墨替换为铜电极,则阴极析出1mol H2
D. 若其他条件不变,将石墨替换为铜电极,则析出Na2SO4·10H2O晶体仍为m g
【答案】D
【解析】本题考查的是电解原理,饱和溶液有关计算等知识点,为高频考点。侧重考查学生分析能力和计算能力,明确饱和溶液的特点,电解时阳极上铜失去电子而不是溶液中的阴离子失去电子是易错点。
A.电解后溶液质量减少量=电解水的质量+析出晶体的质量=(18+m)g,故正确;B.析出硫酸钠的质量为![]() =71/161mg,溶液质量=(18+m)g,溶液质量分数=溶质质量/溶液质量=
=71/161mg,溶液质量=(18+m)g,溶液质量分数=溶质质量/溶液质量= 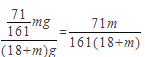 ,故正确;C. 若气体条件不变,将石墨电极替换为铜电极,阴极上仍然是氢离子放电生成氢气,但是阳极上铜失去电子生成铜离子,阴极上析出1mol氢气,故错误;D若其它条件不变,将石墨电极替换为铜电极,阳极上生成铜离子,阴极上生成氢气同时还有氢氧根离子生成,铜离子和氢氧根离子反应生成氢氧化铜沉淀,其电池反应为Cu+2H2O
,故正确;C. 若气体条件不变,将石墨电极替换为铜电极,阴极上仍然是氢离子放电生成氢气,但是阳极上铜失去电子生成铜离子,阴极上析出1mol氢气,故错误;D若其它条件不变,将石墨电极替换为铜电极,阳极上生成铜离子,阴极上生成氢气同时还有氢氧根离子生成,铜离子和氢氧根离子反应生成氢氧化铜沉淀,其电池反应为Cu+2H2O![]() Cu(OH)2+H2↑,根据方程式可知,转移2mol电子,消耗2mol水,则析出Na2SO4·10H2O晶体为2mg,故错误。故选D。
Cu(OH)2+H2↑,根据方程式可知,转移2mol电子,消耗2mol水,则析出Na2SO4·10H2O晶体为2mg,故错误。故选D。


 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:
【题目】将铁粉、铜粉加入到盛有FeCl3、FeCl2、CuCl2的混合液的烧杯中,判断下列情况烧杯中的固体及金属阳离子(用化学式表示):
(1)若反应后铁粉有剩余,则一定有______________。
(2)若反应后有Cu2+和Cu,则不可能有_________。
(3)若反应后有Cu2+和Fe3+,则一定有_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质制备的说法正确的是
A. 电解饱和食盐水可以得到金属钠、氢气和氯气
B. 工业上将氯气通入澄清石灰水中制取漂白粉
C. 用焦炭在高温下还原二氧化硅可得到粗硅
D. 高炉炼铁中利用焦炭直接将铁矿石还原为铁单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作、现象和解释或结论有错误的是( )
选项 | 实验操作 | 现象 | 解释或结论 |
A | 少量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
B |
| 左边棉球变为橙色,右边棉球变为蓝色 | 证明氧化性:Cl2>Br2,但不能证明氧化性:Br2>I2 |
C | 向某溶液中加入硝酸银溶液 | 产生白色沉淀 | 则溶液有氯离子 |
D | 浓HNO3加热 | 有红棕色气体产生 | HNO3有不稳定性 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量Fe、FeO和Fe2O3的混合物中加入150 mL一定浓度的稀硝酸恰好使混合物完全溶解,同时可得到标准状况下1.12 L NO气体。向所得到的溶液中再加入KSCN溶液,无红色出现。若用足量的CO在加热条件下还原相同质量的混合物得到11.2 g铁单质。下列说法正确的是( )
A. 往所得溶液中加入KSCN溶液,无红色出现,则溶液中无Fe2+
B. 原稀硝酸的物质的量浓度为3mol/L
C. 能确定铁和三氧化二铁的物质的量之比
D. 混合物中铁单质为0.075mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示,下列叙述正确的是
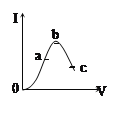
A. a、b、c三点处,溶液中c(H+)由小到大的顺序为a、b、c
B. a、b、c三点处,溶液中CH3COOH分子数:a>b>c
C. a、b、c三点处,c(CH3COO-)最大的是a
D. 若使c点溶液中c(CH3COO-)增大,可采取的措施有加水稀释或加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氧化氮、二氧化氮等氮氧化物是常见的大气污染物,然而它们在工业上有着广泛的用途。
已知:①室温下,2NO+Na2O2=2NaNO2;②酸性条件下,NO或NO2-都能与MnO4—反应生成NO3-。
Ⅰ.以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如下图所示:
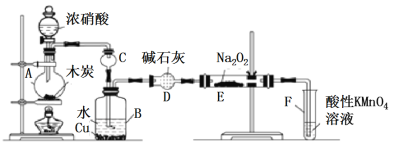
(1)A中反应的化学方程式_____________;
(2)装置B中观察到的主要现象______________;
(3)仪器D的名称是___________________;
(4)A中滴入浓硝酸之前,应先通入N2一段时间,原因是____________;
(5)写出NO被酸性KMnO4氧化的离子反应方程式______________;
(6)若无装置D,则E中产物除NaNO2外,还有_______(填化学式)。
Ⅱ.某研究性学习小组对NO2与Na2O2能否发生反应进行探究。
步骤1:提出假设
假设一:NO2与Na2O2不反应;
假设二:NO2能被Na2O2氧化;
假设三:______________________________________________。
步骤2:设计实验
(1)实验时,将NO2气体通入盛有Na2O2的玻璃管中,淡黄色粉末完全变成白色,说明假设________不成立。
(2)为验证假设二是否成立,该小组同学进行如下定性实验研究,请完成下表内容。
实验步骤(不要求写具体操作过程,试剂、仪器任选) | 预期的实验现象及结论 |
取适量的白色固体置于试管中,加蒸馏水溶解, ①__________________________________________ | ②___________________________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,若在恒压绝热容器中发生,下列选项表明反应一定已达平衡状态的是( )
2NH3(g) ΔH<0,若在恒压绝热容器中发生,下列选项表明反应一定已达平衡状态的是( )
A. 容器内的温度不再变化
B. 容器内的压强不再变化
C. 相同时间内,断开H-H键的数目和生成N-H键的数目相等
D. 容器内气体的浓度c(N2)∶c(H2)∶c(NH3)=1∶3∶2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com