
| A. | BeCl2 | B. | C2H2 | C. | CO2 | D. | NH3 |
分析 根据杂化轨道理论判断分子的构型;在化合物中,原子的最外层电子数+|化合价|=8,该原子满足8电子稳定结构,据此进行解答.
解答 解:A.BeCl2中心原子Be原子成2个σ键,杂化轨道数为2,采取sp杂化,为直线型分子,BeCl2中Be原子的最外层电子数+|化合价|=2+2=4,分子中Be原子不满足8电子结构,故A错误;
B.C2H2的结构式为H-C≡C-H,属于直线形分子,C2H2中H原子不满足8电子结构,故B错误;
C.CO2是直线型结构,CO2中C原子的最外层电子数+|化合价|=4+4=8,C原子满足8电子结构,O原子最外层电子数+|化合价|=6+2=8,O原子满足8电子结构,故C正确;
D.氨气为三角锥型结构,且H原子最外层电子数为2,不满足8电子稳定结构,故D错误;
故选C.
点评 本题考查分子构型与8电子结构的判断,题目难度中等,注意理解价层电子对理论与杂化轨道理论判断分子构型,明确原子核外电子排布规律为解答关键,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:解答题
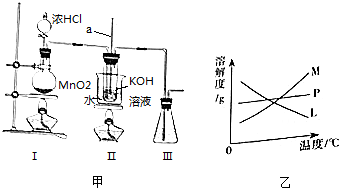
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液晶态介于晶体状态和液态之间,液晶具有一定程度的晶体的有序性和液体的流动性 | |
| B. | 常压下,0℃时冰的密度比水的密度小,水在4℃时密度最大,这些都与分子间的氢键有关 | |
| C. | 乙烯使高锰酸钾褪色和二氧化硫使溴水褪色的原理不相同 | |
| D. | 燃料的脱硫脱氮、SO2的回收利用和NOx的催化转化都是减少酸雨产生的措施 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HNO3和NH4NO3 | B. | NaOH和KCl | C. | NaN3和CaO2 | D. | AlCl3和MgCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2与CO2 | B. | Na与O2 | C. | NaOH与CO2 | D. | NaAlO2与HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属性逐渐增强 | |
| B. | 化合价逐渐升高 | |
| C. | 失电子能力逐渐减弱 | |
| D. | 最高价氧化物对应的水化物碱性逐渐减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
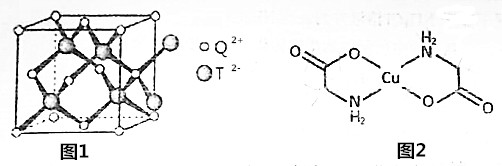
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量二氧化碳通入“水玻璃”中:C02+SiO32-+H20═C032-+H2SiO3↓ | |
| B. | 氨水滴入 AlCl3 溶液中:Al3++30H-═Al(0H)3↓ | |
| C. | 铝溶解在NaOH溶液中:2Al+2OH-+6H2O═2[Al(OH)4]-+3H2↑ | |
| D. | Al2O3溶于 NaOH 溶液中:Al2O3+2OH-+3H2O=2[Al(0H)4]- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com