
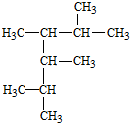
 2,3,4,5-四甲基己烷
2,3,4,5-四甲基己烷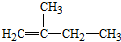 2-甲基-1-丁烯
2-甲基-1-丁烯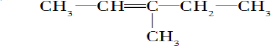 .
. .
. 分析 (1)烷烃的命名时,要选最长的碳链为主链,从离支链近的一端对主链上的碳原子进行编号,据此进行分析;
(2)烯烃命名时,选含官能团的最长的碳链为主链,从离双键近的一端开始编号,用双键两端编号较小的碳原子来表示出双键的位置,支链的表示方法同烷烃;
(3)烯烃命名,①首先选择含有双键最长碳链作为主链,按主链中所含碳原子的数目命名为烯.主链碳原子数在十以内时用天干表示;在十以上时,用中文字十一、十二、…等表示;
②给主链编号时从距离双键最近的一端开始,侧链视为取代基,注明取代基位置,双键的位次须标明,用两个双键碳原子位次较小的一个表示,放在烯烃名称的前面;
(4)苯的同系物的命名:“苯的同系物命名是以苯作母体”,我们再结合烷烃命名的“近、简”原则,不难发现,当苯环上连有多个不同的烷基时,烷基名称的排列应从简单到复杂,环上编号从简单取代基开始.
解答 解:(1)烷烃的命名时,要选最长的碳链为主链,从离支链近的一端对主链上的碳原子进行编号,故名称为:2,3,4,5-四甲基己烷,
故答案为:2,3,4,5-四甲基己烷;
(2)烯烃命名时,选含官能团的最长的碳链为主链,从离双键近的一端开始编号,用双键两端编号较小的碳原子来表示出双键的位置,故名称为:2-甲基-1-丁烯,
故答案为:2-甲基-1-丁烯;
(3)根据名称为3-甲基-2-戊稀可知,主链上有5个碳原子,且在2号和3号碳原子之间有双键,在3号碳原子上有一个甲基,故结构简式为: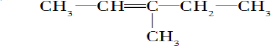 ,
,
故答案为: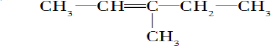 ;
;
(4)1,3,5-三甲苯中苯环连接3个甲基且均处于间位位置,其结构简式为: ,
,
故答案为: .
.
点评 本题考查了有机物命名、有机物结构简式的书写,题目难度中等,注意掌握常见有机物的结构与性质,明确常见有机物的命名原则,能够正确书写常见有机物的结构简式.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,用一充满氨气的干燥烧瓶做喷泉实验,当水充满整个烧瓶后(假设溶液不外溢),烧瓶内氨水的物质的量的浓度为$\frac{1}{22.4}$ mol/L | |
| B. | 氨很容易液化,因此氨常用作制冷剂 | |
| C. | SO3溶于水能导电,所以SO3是电解质 | |
| D. | 浓硝酸在光照条件下变黄,说明浓硝酸不稳定,生成的有色产物能溶于浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6 s | B. | 4 s | C. | 3 s | D. | 2 s |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 环己二烯在脱氢催化剂作用下转变为苯和氢气 | |
| B. | 溴乙烷在NaOH的乙醇溶液中的反应 | |
| C. | 乙酸和乙醇在浓硫酸的作用下生成乙酸乙酯和水 | |
| D. | 乙醛能将新制的Cu(OH)2还原成Cu2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com