
我们已经知道,pH表示溶液中c(H+)的负对数,同样也可以定义pOH表示溶液中c(OH-)的负对数,即pOH=-lg c(OH-),温度T时水的离子积常数用KW表示,此温度下不能判定溶液呈中性的依据是( )
A.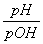 =1 B.pOH=-lg
=1 B.pOH=-lg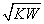
C.c(H+)=10-pOH D.pH+pOH=lg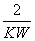
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:高中化学 来源: 题型:
信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70% Cu、25% Al、4% Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
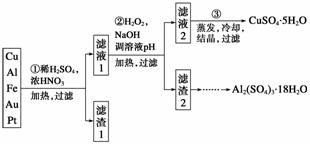
请回答下列问题:
(1)第①步Cu与酸反应的离子方程式为_______________________________________
________________________________________________________________________;
得到滤渣1的主要成分为____________。
(2)第②步加H2O2的作用是______________,使用H2O2的优点是______________;调溶液pH的目的是使______________生成沉淀。
(3)用第③步所得CuSO4·5H2O制备无水CuSO4的方法是________________________。
(4)由滤渣2制取Al2(SO4)3·18H2O ,探究小组设计了三种方案:
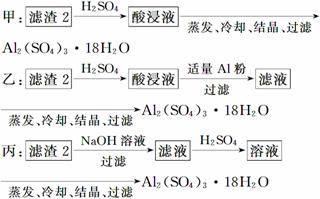
上述三种方案中,________方案不可行,原因是_______________________________
________________________________________________________________________;
从原子利用率角度考虑,__________方案更合理。
查看答案和解析>>
科目:高中化学 来源: 题型:
在25 ℃时,FeS的Ksp=6.3×10-18,CuS的Ksp=1.3×10-36,ZnS的Ksp=1.3×10-24。下列有关说法中正确的是( )
A.25 ℃时,CuS的溶解度大于ZnS的溶解度
B.25 ℃时,饱和CuS溶液中Cu2+的浓度为1.3×10-36 mol·L-1
C.物质的量浓度相同的FeCl2、ZnCl2混合液中加入少量Na2S,只有FeS沉淀生成
D.除去某溶液中的Cu2+,可以选用FeS作沉淀剂
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.0.1 mol/L (NH4)2SO4溶液中的c(NH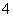 )<c(SO
)<c(SO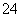 )
)
B.相同温度下,0.6 mol/L氨水溶液与0.3 mol/L氨水溶液中c(OH-)之比是21
C.向0.1 mol/L NaNO3溶液中滴加盐酸使溶液pH=5,此时混合液中的c(Na+)=c(NO )
)
D.常温下,向醋酸钠溶液中加入适量醋酸,使混合液的pH=7,此时混合液中c(Na+)>c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E均为易溶于水的化合物,其离子组成如下。(各化合物中离子组成不重复)
| 阳离子 | Na+、Al3+、Ag+、Ba2+、Fe3+ |
| 阴离子 | Cl-、CO |
分别取溶液进行如下实验:
①用pH试纸分别测得B、C溶液均呈碱性,且0.1 mol/L B溶液pH>13;
②D溶液加入铜粉,溶液质量增加;
③在E溶液中加过量B,没有沉淀产生;
④在A溶液中逐滴滴入氨水至过量,先先成白色沉淀,后沉淀溶解。
请回答下列问题:
(1)B的名称:________,E的名称:________。
(2)C水溶液呈碱性的原因(用离子方程式表示):________;0.1 mol/L的C溶液中和0.1 mol/L的NaHCO3溶液中,阴离子的总数:C溶液________NaHCO3溶液。(填“>”、“=”或“<”)
(3)D溶液呈________(填“酸性”、“碱性”或“中性”);若将D溶液加热蒸干,得到的固体应是:________________________。(填化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
向一定量的K2CO3溶液中缓慢滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶
 液中离子数目也相应地发生变化。如图所示,四条曲线与溶液中的离子的对应关系,完全正确的是
液中离子数目也相应地发生变化。如图所示,四条曲线与溶液中的离子的对应关系,完全正确的是
| a | b | c | d | |
| A | Cl— | K+ | CO32— | HCO3— |
| B | K+ | CO32— | Cl— | HCO3— |
| C | K+ | CO32— | HCO3— | Cl— |
| D | K+ | HCO3— | Cl— | CO32— |
查看答案和解析>>
科目:高中化学 来源: 题型:
在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂过氧化氢,当它们混合时,即产生大量氮气和水蒸气,并放出大量热。已知0.4mol液态肼与足量过氧化氢反应,生成氮气和水蒸气,放出 a kJ的热量。
(1) 写出肼和过氧化氢的电子式:肼: ,过氧化氢: ;
(2) 写出该反应的热化学方程式: ;
(3) 已知H2O(1)==H2O(g) △H= + b kJ/mol,则16g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量是________________ kJ。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com