
【题目】用 NA 表示阿伏加德罗常数的值,下列判断正确的是( )
A.标准状况下,22.4 L CCl4 含有的碳原子数是 NA
B.56 g Fe 与足量稀盐酸反应转移的电子数为 3 NA
C.0.1 mol/L Na2SO4 溶液含有的钠离子数为 0.2 NA
D.常温常压下,2g H2 中含有的分子数为 NA
 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:
【题目】水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2S2O32-+O2+XOH- =Fe3O4+S4O62-+2H2O,下列说法正确的是( )
A. 硫元素被氧化,铁元素被还原
B. Fe2+、S2O32- 都是还原剂
C. X=2
D. 每生成1mol Fe3O4,则转移电子数2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. PCl3的空间构型为平面三角形
B. HF、HCl、HBr、HI的熔沸点依次升高
C. 乳酸(![]() )有一对手性异构体,因为其分子中含有一个手性碳原子
)有一对手性异构体,因为其分子中含有一个手性碳原子
D. 氯的各种含氧酸的酸性由强到弱排列为HClO>HClO2>HClO3>HClO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用软锰矿(主要成分为 MnO2,含有杂质 SiO2、Fe2O3)和高品质硫锰矿(主要成 分为 MnS)制取 KMnO4 的一种工艺流程如下图所示。

请回答下列问题:
(1) “酸浸”工序中,MnO2和 MnS中的 Mn元素转化成 MnSO4,同时生成 S 单质,该反应的离子方程式为________________________________________。
(2)为了提高“酸浸”效率,下列方法可行的是_______________________。
A. 将软锰矿和硫锰矿矿石研磨成矿粉 B. 适当提高体系的温度
C. 使用浓盐酸代替稀硫酸进行酸浸 D. 使用搅拌器对混合物进行搅拌
(3)将“滤液Ⅰ”进行处理后,在温度为 50℃,pH 为 6.4~6.8 的电解槽中持续电解,可使 NaClO3复原,同时获得的副产物是 H2,则阳极的电极反应式为______________________________。
(4) “歧化”时,生成物为 K2CO3、KMnO4 和 MnO2。可通过过滤操作分离出 MnO2,并将其循环 到___________工序,以提高原料利用率。然后通过蒸发浓缩、降温结晶、过滤、洗涤、低 温 烘 干 操 作 获 得 KMnO4 固体 , 洗 涤 时 应 使 用 75% 乙 醇 溶 液 对 固 体 进 行 冲 洗 , 其 优 点是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光气(COCl2)在塑料、制药等工业生产中有许多用途,其化学性质不稳定,遇水迅速产生两种酸性气体。回答下列问题:
(1)少量COCl2可用烧碱溶液吸收,发生反应的离子方程式为________。
(2)工业上用CO和Cl2在高温、活性炭催化作用下合成光气:Cl2(g)+CO(g)![]() COCl2(g) H=-108 kJ·mol-1。所需CO来自CH4与CO2的催化重整反应。查阅文献获得以下数据:
COCl2(g) H=-108 kJ·mol-1。所需CO来自CH4与CO2的催化重整反应。查阅文献获得以下数据:
CH4(g)+2O2(g)==CO2(g)+2H2O(l) H1=-890.3 kJ·mol-1
2H2(g)+O2 (g)==2H2O(l) H2=-571.6 kJ·mol-1
2CO(g)+O2 (g)==2CO2(g) H3=-566 kJ·mol-1
则CH4与CO2催化重整反应生成CO和H2的热化学方程式为_____。
(3)在T ℃时,向盛有活性炭的5 L恒容密闭容器中加入0.6 mol CO和0.45 mol Cl2,CO和COCl2的浓度在不同时刻的变化状况如图所示:

①反应在第6 min时的平衡常数为___,第8 min时改变的条件是____。
②在第12 min时升高温度,重新达到平衡时,COCl2的体积分数将___(填“增大”“不变”或“减小”),原因是_____。
(4)Burns和Dainton研究了反应Cl2(g)+CO(g)![]() COCl2(g)的动力学,获得其速率方程v = k[c(Cl2)]3/2[c(CO)]m,k为速率常数(只受温度影响),m为CO的反应级数。
COCl2(g)的动力学,获得其速率方程v = k[c(Cl2)]3/2[c(CO)]m,k为速率常数(只受温度影响),m为CO的反应级数。
①该反应可认为经过以下反应历程:
第一步:Cl2![]() 2Cl 快速平衡
2Cl 快速平衡
第二步:Cl + CO![]() COCl 快速平衡
COCl 快速平衡
第三步:COCl + Cl2 —→COCl2 + Cl 慢反应
下列表述正确的是____(填标号)。
A.COCl属于反应的中间产物 B.第一步和第二步的活化能较高
C.决定总反应快慢的是第三步 D.第三步的有效碰撞频率较大
②在某温度下进行实验,测得各组分初浓度和反应初速度如下:
实验序号 | c(Cl2)/mol·L-1 | c(CO)/mol·L-1 | v/mol·L-1·s-1 |
1 | 0.100 | 0.100 | 1.2×10-2 |
2 | 0.050 | 0.100 | 4.26×10-3 |
3 | 0.100 | 0.200 | 2.4×10-2 |
4 | 0.050 | 0.050 | 2.13×10-3 |
CO的反应级数m =___,当实验4进行到某时刻,测得c(Cl2) = 0.010mol·L-1,则此时的反应速率v =___mol·L-1·s-1(已知:![]() ≈ 0.32)。
≈ 0.32)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 实验室用氯化铵和熟石灰制氨:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
B. NaOH溶液与NH4Cl溶液混合加热:NH4+ +OH-![]() NH3·H2O
NH3·H2O
C. 氨水中加盐酸:NH3·H2O+H+=NH4++H2O
D. 氨水中加入氯化铁溶液:Fe2++2NH3·H2O=2NH4++Fe(OH)2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】十九大报告指出:“坚持全民共治、源头防治,持续实施大气污染防治行动,打赢蓝天保卫战!”以NOx为主要成分的雾霾的综合治理是当前重要的研究课题。
I.汽车尾气中的NO(g)和CO(g)在一定条件下可发生如下反应:
反应①2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H1
N2(g)+2CO2(g) △H1
(1)已知:反应②N2(g)+O2(g)![]() 2NO(g) △H2=+180.5kJ·mol-1
2NO(g) △H2=+180.5kJ·mol-1
CO的燃烧热为283.0kJ·mol-l,则△H1=___。
(2)在密闭容器中充入5 mol CO和4 mol NO,发生上述反应①,图1为平衡时NO的体积分数与温度、压强的关系。

①温度:T1____T2(填“<”或“>”)。
②若在D点对反应容器升温的同时扩大体积使体系压强减小,重新达到的平衡状态可能是图中A~G点中的____点。
(3)某研究小组探究催化剂对CO、NO转化的影响。将NO和CO以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中NO含量,从而确定尾气脱氮率(脱氮率即NO的转化率),结果如上图2所示。若低于200℃,图2中曲线中脱氮率随温度升高而变化不大的主要原因为____;a点 ___(填“是”或“不是”)对应温度下的平衡脱氮率,说明理由____。
Ⅱ.N2O是一种强温室气体,且易形成颗粒性污染物,研究N2O的分解对环境保护有重要意义。
(4)碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步I2(g)![]() 2I(g)(快反应)
2I(g)(快反应)
第二步I(g)+N2O(g)→N2(g)+IO(g)(慢反应)
第三步IO(g)+N2O(g)→N2(g)+O2(g)+I2(g)(快反应)
实验表明,含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数)。
下列表述正确的是____。
A.N2O分解反应中:k值与是否含碘蒸气无关
B.第二步对总反应速率起决定作用
C.第二步活化能比第三步小
D.IO为反应的中间产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯及其化合物在生产、生活中都有重要的应用:

(Ⅰ)现实验室要配置一定物质的量浓度的稀盐酸。
(1)如图是某市售盐酸试剂瓶标签上的部分数据。则该盐酸的物质的量浓度是___ mol·L-1。
(2)某同学用该浓盐酸配制100mL 1mol·L-1的稀盐酸。请回答下列问题:
①通过计算可知,需要用量筒量取浓盐酸 ____ mL。
②使用的仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有_______。
③若配制过程遇下列情况,溶液的物质的量浓度将会:(填“偏高”“偏低”“无影响”)
A.量取的浓盐酸置于烧杯中较长时间后配制______。
B.转移溶液前,洗净的容量瓶内壁附有水珠而未干燥处理___。
C.定容时俯视容量瓶的刻度线_____。
(Ⅱ)实验室使用浓盐酸、二氧化锰共热制氯气,并用氯气和氢氧化钙反应制取少量漂白粉(该反应放热)。已知:MnO2 + 4HCl(浓) ![]() MnCl2 + Cl2↑+ 2H2O;氯气和氢氧化钙在温度较高时会生成副产物氯酸钙。甲、乙、丙三位同学分别设计了三个实验装置如下图所示:
MnCl2 + Cl2↑+ 2H2O;氯气和氢氧化钙在温度较高时会生成副产物氯酸钙。甲、乙、丙三位同学分别设计了三个实验装置如下图所示:
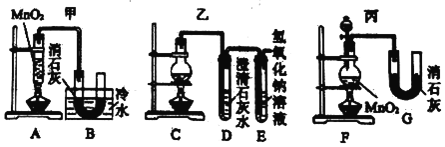
(1)哪位同学的装置能够有效地防止副反应的发生?_____。
(2)上述装置中,甲由A、B两部分组成,乙由C、D、E三部分组成,丙由F、G两部分组成。从上述甲、乙、丙三套装置中选出合理的部分(按气流从左至右的流向)组装一套较完善的实验装置(填所选部分的字母)_____。
(3)利用(2)中实验装置进行实验,实验中若用12 mol·L-1的浓盐酸200 mL与足量二氧化锰反应,最终生成的次氯酸钙的物质的量总小于0.3 mol,其可能的主要原因是_____(假定各步反应均无反应损耗且无副反应发生)。
(Ⅲ)已知HClO的杀菌能力比ClO-强。25℃时将氯气溶于水形成氯气一氯水体系,该体系中Cl2、HClO和ClO-的物质的量分数(a)随pH变化的关系如图所示。
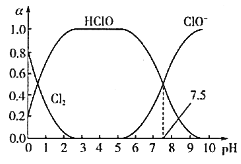
由图分析,欲使氯水的杀菌效果最好,应控制的pH范围是__,当pH=7.5时,氯水中含氯元素的微粒有___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A,B,C,D,E五种元素,其中A,B,C,D为短周期元素,A元素的周期数、主族数、原子序数相同;B原子核外有3种能量不同的原子轨道且每种轨道中的电子数相同;C原子的价电子构型为csccpc+1,D元素的原子最外层电子数比次外层电子数少2个,D的阴离子与E的阳离子电子层结构相同,D和E可形成化合物E2D.
(1)上述元素中,第一电离能最小的元素的原子结构示意图为__;D的价电子排布图为__;
(2)下列分子结构图中的●和○表示上述元素的原子中除去最外层电子的剩余部分,小黑点表示没有形成共价键的最外层电子,短线表示共价键.

则在以上分子中,中心原子采用sp3杂化形成化学键的是__(填写分子的化学式); 在③的分子中有__个σ键和__个π键.
(3)A,C,D可形成既具有离子键又具有共价键的化合物,其化学式可能为__;足量的C的氢化物水溶液与CuSO4溶液反应生成的配合物,其化学式为__,请说出该配合物中中心原子与配位体及内界与外界之间的成键情况:__.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com