
【题目】2019年诺贝尔化学奖授予研发锂离子电池的三位科学家。磷酸亚铁锂(![]() )常用于生产锂离子电池,请回答下列问题:
)常用于生产锂离子电池,请回答下列问题:
(1)![]() 中Li元素的化合价为______。
中Li元素的化合价为______。
(2)某锂离子电池放电时,![]() 以阳离子的形式脱离
以阳离子的形式脱离![]() 电极后,剩余的
电极后,剩余的![]() 本身会转变为一种电中性化合物,该化合物的化学式为____,放电过程中
本身会转变为一种电中性化合物,该化合物的化学式为____,放电过程中![]() ;发生了______(填“氧化”或“还原”)反应。
;发生了______(填“氧化”或“还原”)反应。
科目:高中化学 来源: 题型:
【题目】下列有关热化学反应的描述正确的是( )
A.HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ/mol
B.CO的燃烧热ΔH=-283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g) ΔH=(2×283.0)kJ/mol
C.已知:C(s)+O2(g)=CO2(g)△H1;C(s)+![]() O2(g)=CO(g)△H2 ,则△H1>△H2
O2(g)=CO(g)△H2 ,则△H1>△H2
D.C(石墨,s)= C(金刚石,s) ΔH=+1.9kJ·mol-1 ,则金刚石比石墨稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某气态烷烃和某气态单烯烃(只含一个碳碳双键)组成的混合气体在同温、同压下是氢气密度的13倍,取标准状况下此混合气体4.48L,通入足量溴水中,溴水质量增加2.8g,则此混合气体可能是( )
A.甲烷和丙烯B.乙烷和丙烯
C.甲烷和2-甲基丙烯D.乙烷和1-丁烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示。又知AgCl的Ksp=1.8×10-10。下列说法不正确的是( )
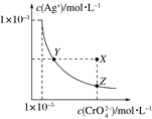
A.t℃时,Ag2CrO4的Ksp为1×10-8
B.饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点
C.t℃时,Y点和Z点时Ag2CrO4的Ksp相等
D.t℃时,将0.01 mol·L-1AgNO3溶液滴入20 mL 0.01 mol·L-1KCl和0.01 mol·L-1K2CrO4的混合溶液中,Cl-先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种有机醚,可由链烃A(分子式为C4H6)通以下路线制得,下列说法正确的是( )
是一种有机醚,可由链烃A(分子式为C4H6)通以下路线制得,下列说法正确的是( )
A![]() B
B![]() C
C![]()
![]()
A.A的结构简式是CH2=CHCH2CH3
B.C在Cu或Ag做催化剂、加热条件下能被O2氧化为醛
C.B中含有的官能团有溴原子、碳碳双键
D.①②③的反应类型分别为加成反应、取代反应、消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据有机物的命名原则,下列命名正确的是( )
A.CH2Br—CH2Br 二溴乙烷B.CH3CH(C2H5)CH2CH2CH3 2—乙基戊烷
C.CH3OOCCH3 甲酸乙酯D.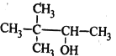 3,3—二甲基—2—丁醇
3,3—二甲基—2—丁醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃A的相对分子质量为84。回答下列问题:
(1)该烃的分子式为___,下列物质与A以任意比例混合,若总物质的量一定,充分燃烧消耗氧气的量不变的是___(填序号)。
a.C7H12O2 b.C6H14 c.C6H14O2 d.C7H14O2
(2)若烃A为链烃,与HBr加成后只能得到一种产物,且该烃的一氯代物只有一种。
①A的结构简式为___;
②链烃A与溴的CCl4溶液反应生成B;B与NaOH的醇溶液共热可得到D,D分子中无溴原子。请写出由B制备D的化学方程式:___;
(3)若核磁共振氢谱显示链烃A有三组不同的峰,峰面积比为3∶2∶1,则A的可能的结构有几种___(不考虑顺反异构)。
(4)若A不能使溴水褪色,且其一氯代物只有一种,则A的结构简式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乳酸亚铁晶体([CH3CH(OH)COO]2Fe·3H2O,Mr=288)是常用的补铁剂易溶于水,吸收效果比无机铁好。乳酸亚铁可由乳酸与FeCO3反应制得。
I.制备碳酸亚铁(FeCO3)
已知FeCO3易被氧化:4FeCO3+6H2O+O2=4Fe(OH)3+4CO2。某兴趣小组设计如下方案制备FeCO3,实验装置如图:
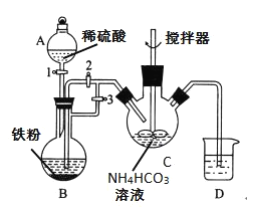
(1)仪器B的名称是__。
(2)利用如图所示装置进行实验,进行以下两步操作:
第一步:打开活塞1、3,关闭活塞2,反应一段时间;
第二步:关闭活塞3,打开活塞2,发现C中有白色沉淀和气体生成。
①第一步骤的目的是__。
②C中反应生成白色沉淀的离子方程式是:__。
③仪器C中的混合物经过滤,洗涤后得到FeCO3沉淀。实验室中进行过滤后沉淀洗涤的操作是:__。
④装置D中可盛装适量的水,该装置作用是__。
II.制备乳酸亚铁晶体和定量测量
(1)制备乳酸亚铁晶体。将制得的FeCO3加入到乳酸溶液中,加入少量铁粉,在70℃下搅拌使反应充分进行,一段时间后,经过分离提纯操作,从所得溶液中得到乳酸亚铁晶体。现需要设计实验检测产品在制备过程是否因氧化而发生变质,可选用的试剂__。
(2)用碘量法测定晶体样品中铁元素的含量并计算样品的纯度。称取3.00g晶体样品,在足量空气中灼烧成灰,加足量稀硫酸溶解,将所有可溶物配成l00mL溶液。取25.00mL该溶液加入过量的KI反应,加入几滴__(试剂名称)作指示剂,用0.l0mol/L的硫代硫酸钠溶液滴定(I2+2S2O32-=S4O62-+2I-),重复实验3次,滴定终点时平均消耗硫代硫酸钠25.00mL,则样品纯度为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,向NaHCO3溶液中滴入盐酸,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是

A.25 ℃时,H2CO3的一级电离Ka1(H2CO3)=1.0×10-6.4
B.M点溶液中:c(H+)+ c(H2CO3)=c(Cl-) +2c(CO32-) +c(OH-)
C.25 ℃时,HC![]() +H2O
+H2O![]() H2CO3+OH-的Kh=1.0×10-7.6
H2CO3+OH-的Kh=1.0×10-7.6
D.图中a=2.6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com