
下列物质的除杂方法中,合理的是( )
①C2H6中混有的C2H4,可以将混合气体先通过溴水,然后用碱石灰干燥
②K2CO3中混有的少量NaHCO3,可以用加热的方法除去
③乙烯中混有的SO2气体可以通过酸性高锰酸钾溶液除去
④金属铜中含有的少量银和锌可以通过电解精炼的方法除去
⑤H2S中混有的水蒸气用浓硫酸干燥即可
A.①④ B.②③ C.①⑤ D.④⑤
科目:高中化学 来源:2014年高考化学指导冲关 第11练化学实验基础知识练习卷(解析版) 题型:选择题
某未知溶液中已检验出含大量的Fe2+、SO42— ,且pH=1。欲检验此溶液中是否大量存在以下离子:①NH4+、② SiO32—、③Mg2+、④Cl-、⑤Ca2+、⑥ClO-,其中不需要检验就可以否定的离子是( )
A.①③⑤ B.②⑤⑥ C.①②⑥ D.③④⑥
查看答案和解析>>
科目:高中化学 来源:2014年高考化学二轮复习指导预测押题练习卷(三) (解析版) 题型:实验题
某化学学习小组在实验室中探究铁钉与热浓硫酸的反应。其探究流程如图所示:
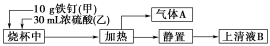
(1)从实验安全的角度考虑,应先向烧杯中加入______(填“甲”或“乙”)。
(2)根据加入的反应物的量,实验需要选取的烧杯的规格为________(填字母序号)。
a.50 mL b.100 mL c.500 mL d.1 000 mL
(3)上述流程图中从“静置”后的混合物中得到上清液B不能采用过滤的操作方法,其原因是__________________________________。
由于铁钉生锈,上清液B中可能既含Fe3+,又含Fe2+,要检验上清液B中有无Fe2+,应加入的试剂是________(填字母序号)。
a.KSCN溶液和氯水
b.铁粉和KSCN溶液
c.NaOH溶液
d.酸性KMnO4溶液
(4)气体A的主要成分是SO2,还可能含有H2和CO2。流程图中“加热”时可能生成CO2的原因是________________(用化学方程式表示)。
利用下列仪器可以同时检验气体A中是否含有H2和CO2(其中的夹持仪器、橡胶管和加热装置已经略去),则仪器的连接顺序是________(填仪器的字母代号),装置A的作用是____________________________,装置B中试剂X的化学式是________。
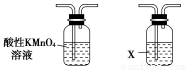
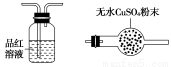
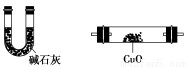
A B C D E F
查看答案和解析>>
科目:高中化学 来源:2014年高考化学二轮复习指导预测押题练习卷(一) (解析版) 题型:选择题
已知Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g) ΔH<0;则下列叙述不正确的是( )
A.该反应的ΔH值与反应物用量无关
B.该反应的化学能可以转化为电能
C.反应物的总能量高于生成物的总能量
D.该反应中反应物的化学键断裂放出能量,生成物化学键形成吸收能量
查看答案和解析>>
科目:高中化学 来源:2014年高考化学二轮复习专题滚动练4 化学实验练习卷(解析版) 题型:填空题
碳酸钙常用作牙膏的摩擦剂。某同学设计了一种制备碳酸钙的方案,其流程图如下:(所用石灰石含有杂质SiO2)

回答下列问题:
(1)充分煅烧110吨石灰石得到固体66吨。标准状况下生成二氧化碳的体积为______________L,石灰石中碳酸钙的质量分数为______________%。
(2)假设第①步反应完全进行,则第②步反应过滤后得到的不溶性滤渣的成分为________________________。
(3)第③步反应一般不采用通入CO2的主要原因是______________________,
相应的离子方程式为_____________________________________。
(4)CaCO3是一种难溶物质,25℃时其Ksp=2.8×10-9。现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2.0×10-4 mol/L,则生成沉淀所需CaCl2溶液的物质的量浓度最小是______________。
(5)某学生用石灰石为原料,设计了另一种制备碳酸钙的实验方案,其流程图如下:

与前一方案相比较,该方案的优点是_________________________________。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学二轮复习专题滚动练4 化学实验练习卷(解析版) 题型:选择题
在下列溶液中,各组离子一定能够大量共存的是( )
A.能使广泛pH试纸显蓝色的溶液:K+、Ba2+、Cl-、Br-
B.常温下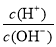 =1012的溶液:Fe2+、Mg2+、NO3-、Cl-
=1012的溶液:Fe2+、Mg2+、NO3-、Cl-
C.含有大量Al3+的溶液:Na+、Cl-、AlO2-、OH-
D.能使淀粉碘化钾试纸显蓝色的溶液:K+、SO42-、S2-、SO32-
查看答案和解析>>
科目:高中化学 来源:2014年高考化学二轮复习专题滚动练3 元素及其化合物练习卷(解析版) 题型:选择题
下列化学实验事实及其结论都正确的是( )
选项实验事实结论
A将SO2通入含HClO的溶液中生成H2SO4HClO酸性比H2SO4强
B铝箔在酒精灯火焰上加热熔化但不滴落铝箔表面氧化铝熔点高于铝
CSiO2可以和NaOH溶液及HF溶液反应SiO2属于两性氧化物
D将SO2通入溴水中,溴水褪色SO2具有漂白性
查看答案和解析>>
科目:高中化学 来源:2014年高考化学二轮复习专题滚动练2 化学基本理论练习卷(解析版) 题型:选择题
在相同的温度下,体积均为0.25 L的两恒容密闭容器中发生可逆反应:N2(g)+3H2(g) 2NH3(g) ΔH=-92.6 kJ/mol。实验测得起始、平衡时的有关数据如表所示,下列叙述错误的是( )
2NH3(g) ΔH=-92.6 kJ/mol。实验测得起始、平衡时的有关数据如表所示,下列叙述错误的是( )
| 起始时各物质的物质 的量(mol) | 达到平衡时能量变化 | ||
容器编号 | N2 | H2 | NH3 | |
① | 1 | 3 | 0 | 放出23.15 kJ能量 |
② | 0.9 | 2.7 | 0.2 | 放出Q kJ能量 |
A.容器①、②中反应的化学平衡常数相等
B.平衡时,两容器中氨气的体积分数均为14.3%
C.反应②达到平衡时,放出的热量Q=23.15 kJ
D.若①的体积为0.5 L,则达到平衡时放出的热量小于23.15 kJ
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后训练专题练习卷二(解析版) 题型:选择题
某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构如图所示,电池总反
应可表示为2H2+O2=2H2O,下列有关说法正确的是( )
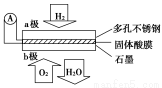
A.电子通过外电路从b极流向a极
B.b极上的电极反应式为O2+2H2O+4e-=4OH-
C.每转移0.1 mol电子,消耗1.12 L的H2
D.H+由a极通过固体酸电解质传递到b极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com