
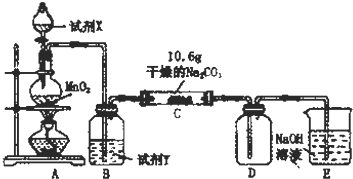
| 实验步骤 | 预期现象和结论 |
| 步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水 至固体溶解,然后将所得溶液分别置于A、B试管中. | |
| 步骤2:向A试管中滴加适量BaCl2溶液. | a.若无明显现象,证明固体中不含Na2CO3 b.若溶液变浑浊,证明固体中含Na2CO3 |
| 步骤3:向B试管中滴加过量的稀硝酸,再滴加AgNO3溶液 | 若溶液变浑浊,证明固体中含有NaCl |
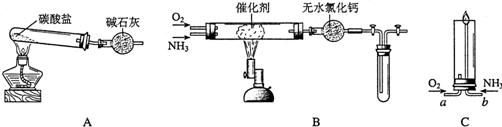
分析 (1)实验室制备氯气是二氧化锰和浓盐酸加热反应生成氯化锰、氯气和水;
(2)①在装置C中通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体(含氯氧化物).C中含氯元素的盐只有一种,且含有NaHCO3.
假设存在两种成分,为NaHCO3和NaCl;
假设存在三种成分,应还有未完全反应的Na2CO3,即是NaHCO3、NaCl和Na2CO3;
②步骤2中向A试管中滴加适量BaCl2溶液,是检验产物中是否有Na2CO3,回答该小题时要结合最后的结论,a应为证明固体中不含Na2CO3,b应为证明固体中含Na2CO3,不能颠倒.
步骤3应是检验氯离子,应向B试管中滴加过量的稀硝酸,再滴加AgNO3溶液,若溶液变浑浊,证明固体中含有NaCl;
(3)依据氧化还原反应电子守恒计算判断氯元素化合价写出化合物化学式,依据反应物和生成物配平书写化学方程式.
解答 解:(1)实验室制备氯气,结合装置分析可知是利用二氧化锰和浓盐酸加热反应生成氯气,反应的离子方程式为:4H++2Cl-+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
故答案为:4H++2Cl-+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)①在装置C中通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体(含氯氧化物).C中含氯元素的盐只有一种,且含有NaHCO3.
假设存在两种成分,为NaHCO3和NaCl;
假设存在三种成分,应还有未完全反应的Na2CO3,即是NaHCO3、NaCl和Na2CO3.
假设一:存在NaHCO3和NaCl;
假设二:存在NaHCO3和NaCl、Na2CO3;
故答案为:NaCl;NaCl、Na2CO3;
②步骤2中向A试管中滴加适量BaCl2溶液,是检验产物中是否有Na2CO3,回答该小题时要结合最后的结论,a应为证明固体中不含Na2CO3,b应为证明固体中含Na2CO3,不能颠倒.
步骤3应是检验氯离子,应向B试管中滴加过量的稀硝酸,再滴加AgNO3溶液,若溶液变浑浊,证明固体中含有NaCl;
| 实验步骤 | 预期现象和结论 |
| 步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中. | 无明显现象 |
| 步骤2:向A试管中滴加BaCl2溶液 | a.若无明显现象,证明固体中不含Na2CO3 b.若溶液变浑浊,证明固体中含Na2CO3 |
| 步骤3:向B试管中滴加过量的稀硝酸,再滴加AgNO3溶液 | 若溶液变浑浊,证明固体中含有NaCl |
| 实验步骤 | 预期现象和结论 |
| 无明显现象 | |
| a.若无明显现象,证明固体中不含Na2CO3 b.若溶液变浑浊,证明固体中含Na2CO3 | |
| 步骤3:向B试管中滴加过量的稀硝酸,再滴加AgNO3溶液 | 若溶液变浑浊,证明固体中含有NaCl |
点评 本题考查了物质性质验证的实验设计,步骤分析判断,现象分析理解,掌握物质性质和实验设计方法是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
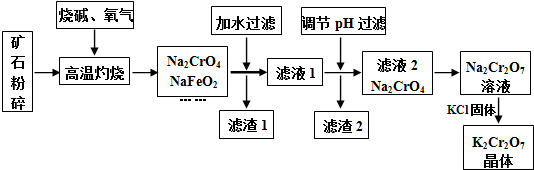
| 时间/(s) | 0 | 0.01 | 0.02 | 0.03 | 0.04 |
| (CrO42-)/(mol•L-1) | 0.20 | 1.6×10-2 | 1.2×10-2 | 1.0×10-2 | |
| (Cr2O72-)/(mol•L-1) | 0 | 9.2×10-2 | 9.4×10-2 | 9.5×10-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
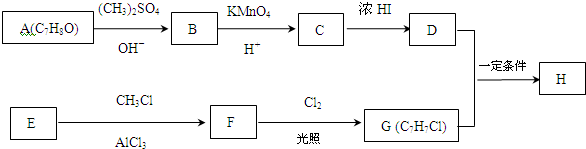
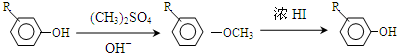

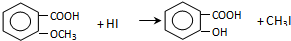 .
. +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$ +HCl,反应类型为取代反应.
+HCl,反应类型为取代反应.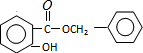 .
. (或
(或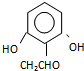 )(任写一种即可)
)(任写一种即可) 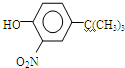
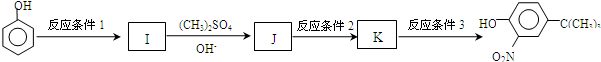
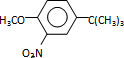 ,反应条件3所用的试剂为浓HI.
,反应条件3所用的试剂为浓HI.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
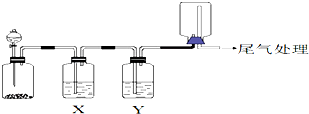
| 选项 | 实验目的 | X中试剂 | Y中试剂 |
| A | 用MnO2和浓盐酸制取并收集纯净干燥的Cl2 | 饱和食盐水 | 浓硫酸 |
| B | 用Cu与稀硝酸制取并收集纯净干燥的NO | 水 | 浓硫酸 |
| C | CaCO3和稀盐酸制取并收集纯净干燥的CO2 | 饱和NaHCO3溶液 | 浓硫酸 |
| D | 氨水与生石灰反应制取并收集纯净干燥的NH3 | 饱和NaOH溶液 | 浓硫酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
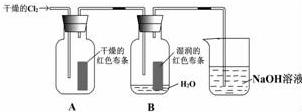 某同学设计了如图的实验:
某同学设计了如图的实验:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .MX与水反应可放出气体,该反应的化学方程式为NaH+H2O=NaOH+H2↑.
.MX与水反应可放出气体,该反应的化学方程式为NaH+H2O=NaOH+H2↑.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
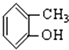 ⑥
⑥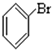 ⑦
⑦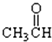 ⑧
⑧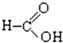 ⑨
⑨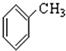 ⑩
⑩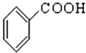
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com