
分氧化的Fe、Cu合金样品(氧化产物为Fe2O3、CuO)共8.0 g,进行如下处理:
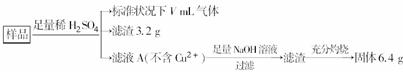
下列说法正确的是( )
A.滤液A中的阳离子为Fe2+、Fe3+、H+
B.样品中金属Fe的质量为4.48 g
C.样品中CuO的质量为4.0 g
D.V=1344
解析:分析流程知发生如下反应:Fe+H2SO4===FeSO4+H2↑,Fe2O3+3H2SO4 === Fe2(SO4)3+3H2O,CuO+H2SO4===CuSO4+H2O,CuSO4+Fe===FeSO4+Cu,Fe2(SO4)3+Fe===3FeSO4。A项,因滤液A中没有Cu2+,所以样品中Cu元素全部转化成Cu单质,即3.2 g滤渣是Cu单质,则此时滤液A中肯定有Fe2+、H+,不可能有Fe3+ ,因为Fe3+会与Cu发生氧化还原反应,错误;B项,样品中的Fe元素最终全部转移到6.4 g固体中,该固体是Fe2O3,n(Fe2O3)=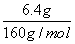 =0.04 mol,所以样品中n(Fe元素)=0.04 mol×2=0.08 mol,m(Fe元素)=0.08 mol×56 g/mol=4.48 g,因样品中含有Fe2O3,所以金属Fe的质量小于4.48 g,错误;C项,由Cu元素守恒知样品中n(Cu元素)=
=0.04 mol,所以样品中n(Fe元素)=0.04 mol×2=0.08 mol,m(Fe元素)=0.08 mol×56 g/mol=4.48 g,因样品中含有Fe2O3,所以金属Fe的质量小于4.48 g,错误;C项,由Cu元素守恒知样品中n(Cu元素)=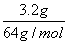 =0.05 mol,若全部以CuO形式存在,则m(CuO)=0.05 mol×80 g/mol=4.0 g,这与实际情况不符,错误;D项,设样品中Fe2O3为x mol,CuO为y mol,则样品中O元素n(O元素)=3x+y=
=0.05 mol,若全部以CuO形式存在,则m(CuO)=0.05 mol×80 g/mol=4.0 g,这与实际情况不符,错误;D项,设样品中Fe2O3为x mol,CuO为y mol,则样品中O元素n(O元素)=3x+y= =
= =0.02 mol,再由上述Fe单质发生的反应知n(Fe单质)=n(H2)+n(CuO)+n(Fe2O3)=(
=0.02 mol,再由上述Fe单质发生的反应知n(Fe单质)=n(H2)+n(CuO)+n(Fe2O3)=(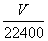 +y+x) mol+2x mol,变形得
+y+x) mol+2x mol,变形得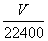 =0.08 mol-(3x+y) mol,所以
=0.08 mol-(3x+y) mol,所以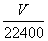 =(0.08-0.02) mol=0.06 mol,V=1344。
=(0.08-0.02) mol=0.06 mol,V=1344。
答案:D
点拨:本题考查化学计算。难度较大。


科目:高中化学 来源: 题型:
实验室用燃烧法测定某种氨基酸
(CxHyOzNμ)的分子组成。取w g该种氨基酸放在纯氧中充分燃烧,生成CO2、H2O和N2。现用如图所示装置进行实验(铁架台、铁夹、酒精灯等均未画出),请回答有关问题。

(1)实验开始时,首先打开止水夹a,关闭止水夹b,通入一段时间的纯氧,这样做的目的是__________________________________;之后则需关闭止水夹_____________,打开止水夹______________。
(2)以上装置中需要加热的是(填装置代号)_____________,操作时应先点燃__________处的酒精灯。
(3)装置A中发生反应的化学方程式是_________________________________。
(4)装置D的作用是_________________________________________________。
(5)读取N2的体积时,应注意:
①________________________________________________________________;
②________________________________________________________________。
(6)实验中测得N2的体积为V mL(已换算为标准状况)。为确定此氨基酸的分子式,还需要的有关数据有__________。
A.生成二氧化碳气体的质量
B.生成水的质量
C.通入氧气的体积
D.该氨基酸的相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下列实验现象得出的结论正确的是( )
| 选项 | 实验现象 | 结论 |
| A | 将BaSO4浸泡在饱和Na2CO3溶液中,部分BaSO4转化为BaCO3 | Ksp(BaSO4)>Ksp(BaCO3) |
| B | 某溶液中加入盐酸酸化的BaCl2溶液,有白色沉淀生成 | 该溶液中一定存在SO |
| C | 滴有酚酞的Na2CO3溶液中加入BaCl2固体,红色变浅 | Na2CO3溶液中存在水解平衡 |
| D | 溴水中通入SO2,溴水褪色 | SO2具有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
用FeCl3酸性溶液脱除H2S后的废液,通过控制电压电解得以再生。某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1 mol/L FeCl2溶液,研究废液再生机理。记录如下(a、b、c代表电压值):
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅰ | x≥a | 电极附近出现黄色,有气泡产生 | 有Fe3+、有Cl2 |
| Ⅱ | a>x≥b | 电极附近出现黄色,无气泡产生 | 有Fe3+、无Cl2 |
| Ⅲ | b>x>0 | 无明显变化 | 无Fe3+、无Cl2 |
(1)用KSCN溶液检验出Fe3+的现象是________________________。
(2)Ⅰ中,Fe3+产生的原因可能是Cl-在阳极放电,生成的Cl2将Fe2+氧化。写出有关反应:________________________________________________________________________。
(3)由Ⅱ推测,Fe3+产生的原因还可能是Fe2+在阳极放电,原因是Fe2+具有________性。
(4)Ⅱ中虽未检验出Cl2,但Cl-在阳极是否放电仍需进一步验证。电解pH=1的NaCl溶液做对照实验,记录如下:
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅳ | a>x≥c | 无明显变化 | 有Cl2 |
| Ⅴ | c>x≥b | 无明显变化 | 无Cl2 |
①NaCl溶液的浓度是________mol/L。
②Ⅳ中检验Cl2的实验方法:_________________________________________________。
③与Ⅱ对比,得出的结论(写出两点):________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是一种综合处理SO2废气的工艺流程。下列说法正确的是( )
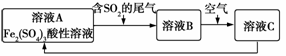
A.向B溶液中滴加KSCN溶液,溶液变为血红色
B.溶液B转化为溶液C发生的变化的离子方程式为4H++4Fe2++O2===4Fe3++2H2O
C.溶液酸性:A>B>C
D.加氧化亚铁可以使溶液C转化为溶液A
查看答案和解析>>
科目:高中化学 来源: 题型:
1-氯丙烷与强碱的醇溶液共热后,生成的产物再与溴水反应,得到一种有机物A,A的同分异构体(包括A)共有( )
A.3种 B.4种
C.5种 D.6种
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作正确的是( )
|
| A. | 乙烷中混有少量乙烯,用氢气加成除去乙烯 |
|
| B. | 将等体积、等浓度的NaOH与CuSO4溶液混合制得氢氧化铜浊液,用于检验醛基 |
|
| C. | 除去苯中的少量苯酚,可加溴水振荡后滤去白色沉淀 |
|
| D. | 溴乙烷与氢氧化钠溶液共煮后,先加硝酸酸化,再加入硝酸银溶液以检验溴元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)在1 L 1 mol·L-1的氨水中( )
A.含有1 mol NH3分子
B.含有NH3和NH 物质的量之和为1 mol
物质的量之和为1 mol
C.含1 mol NH3·H2O
D.含NH3、NH3·H2O、NH 物质的量之和为1 mol
物质的量之和为1 mol
(2)①NH3能进行喷泉实验的原因是
________________________________________________________________________。
②喷泉实验成功的关键是
_________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com