
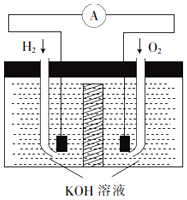
 ����ȼ�ϵ���Ƿ�����ɫ��ѧ��������ͷ���װ�ã��乤��ԭ����ͼ��ʾ���õ�صĵ缫�������һ��ϸС�IJ��ۣ���֪���������������ǿ���������ȶ���
����ȼ�ϵ���Ƿ�����ɫ��ѧ��������ͷ���װ�ã��乤��ԭ����ͼ��ʾ���õ�صĵ缫�������һ��ϸС�IJ��ۣ���֪���������������ǿ���������ȶ������� ��1������ȼ�ϵ������ԭ��أ���ѧ��ת��Ϊ���ܣ�
��2��������ȼ��ʧ���ӷ���������Ӧ��
��3����Ӧ��ĽӴ����Խ��Ӧ����Խ�죻
��4������ȼ�ϵ���ܷ�ӦΪ������������Ӧ����ˮ�����µ������ҺKOHŨ�Ƚ��ͣ��ݴ��жϣ�
��� �⣺��1������ȼ�ϵ������ԭ��أ������ǽ���ѧ��ת��Ϊ���ܵ�װ�ã��ʴ�Ϊ����ѧ��ת��Ϊ���ܣ�
��2������������ʧ���Ӻ����������ӷ�Ӧ����ˮ���缫��ӦΪH2-2e-+2OH-=2H2O���ʴ�Ϊ��������H2-2e-+2OH-=2H2O��
��3����Ӧ��ĽӴ����Խ��Ӧ����Խ�죬�缫����Ʋ��ۣ�����缫��λ�������H2��O2���������ӿ췴Ӧ���ʣ��ʴ�Ϊ������缫��λ�������H2��O2���������ӿ췴Ӧ���ʣ�
��4������ȼ�ϵ���ܷ�ӦΪ������������Ӧ����ˮ�����µ������ҺKOHŨ�Ƚ��ͣ����Լ������ʴ�Ϊ��������
���� ���⿼����ԭ��ع���ԭ����д�缫��ӦʽҪע���ϵ������Һ��д������������Һ��ͬ����Ȼԭ����ͬ���缫��ӦʽҲ��ͬ��������ȼ�ϵ�أ��������Ϊ����缫��Ӧʽ�Ͳ�ͬ��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 1915��ŵ��������ѧ������HenryBragg��LawrenceBragg���Ա���������X���߶Ծ���ṹ�ķ��������Ĺ��ף�
1915��ŵ��������ѧ������HenryBragg��LawrenceBragg���Ա���������X���߶Ծ���ṹ�ķ��������Ĺ��ף�| ���� | NaCl | KC1 | CaO |
| ������/��kJ•mol-1�� | 786 | 715 | 3401 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
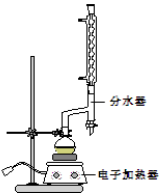 ������������C9H10O2������ˮ����ζ������������ˮ�㾫�����쾫�ͣ���������ʳƷ��ҵ�У�Ҳ�������л��ϳ��м��塢�ܼ��ȣ����Ʊ�����Ϊ��
������������C9H10O2������ˮ����ζ������������ˮ�㾫�����쾫�ͣ���������ʳƷ��ҵ�У�Ҳ�������л��ϳ��м��塢�ܼ��ȣ����Ʊ�����Ϊ��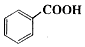 +C2H5OH$\stackrel{H_{2}SO_{4}}{?}$
+C2H5OH$\stackrel{H_{2}SO_{4}}{?}$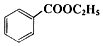 +H2O
+H2O| ��ɫ��״̬ | �е㣨�棩 | �ܶȣ�g•cm-3�� | |
| ������* | ��ɫƬ״���� | 249 | 1.2659 |
| ���������� | ��ɫ����Һ�� | 212.6 | 1.05 |
| �Ҵ� | ��ɫ����Һ�� | 78.3 | 0.7893 |
| ������ | ��ɫ����Һ�� | 80.8 | 0.7318 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ڢ� | B�� | �٢ڢ� | C�� | �ڢۢܢ� | D�� | �٢ڢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | OH-��H2O | B�� | NH3��NH4+ | C�� | H3O+��NH2- | D�� | HC1��H2S |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��7�����ڣ�18���� | |
| B�� | ��IA��Ԫ��Ҳ��Ϊ�����Ԫ�� | |
| C�� | Ԫ������������Ϊ��IIIB�� | |
| D�� | ����������������������50��Ԫ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
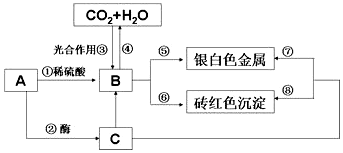
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
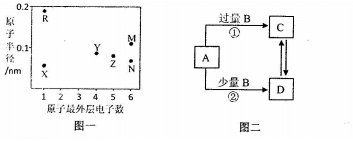
 ��
�� ��������˫��ˮ�����������·�Ӧ���������������壬�����ӷ���ʽΪ2CN-+5H2O2+2H+�TN2��+2CO2��+6H2O��
��������˫��ˮ�����������·�Ӧ���������������壬�����ӷ���ʽΪ2CN-+5H2O2+2H+�TN2��+2CO2��+6H2O���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com