
| A. | 铜的化学性质比铁稳定,在铁闸上安装铜块可减慢铁闸的腐蚀速率 | |
| B. | 氢氧燃料电池正极消耗5.6 L气体时,电路中通过的电子数为6.02×1023个 | |
| C. | 若2NO(g)+2CO(g)═N2(g)+2CO2(g)在常温下能自发进行,则该反应的△H<0 | |
| D. | 相同条件下,100 mL pH=3的HA溶液与HB溶液分别与足量的锌反应,HB放出氢气较多,说明HB酸性比HA的弱 |
分析 A.铜的金属活泼性比铁的弱,形成原电池反应,加快腐蚀;
B.未指明标准状况无法计算;
C.正反应为熵减的反应,根据△H-T△S=△G<0反应自发进行,据此判断;
D.pH相等的不同一元酸,相同体积时生成氢气越多其浓度越大.
解答 解:A.铜的金属活泼性比铁的弱,形成原电池反应,铁为负极,加快腐蚀,故A错误;
B.未指明标准状况无法计算,故B错误;
C.正反应为熵减的反应,即△S<0,常温下能自发进行,根据△H-T△S=△G<0反应自发进行,可推知该反应△H<0,故C正确;
D.pH相等的不同一元酸,相同体积时生成氢气越多其浓度越大,所以HA的浓度大于HB,HB的浓度大于HA,但两种溶液中氢离子浓度相等,说明HB的电离程度小,则酸性弱,故D正确.
故选CD.
点评 本题比较综合,是常见题型,涉及金属腐蚀与防护、化学反应进行方向、离子浓度大小比较等,难度不大,侧重对基础知识的考查.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:选择题
| A. | CO2的分子模型示意图: | |
| B. | 甲烷的电子式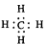 | |
| C. | 硫离子核外电子排布式1s22s22p63s23p4 | |
| D. | 中子数为8的碳原子86C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 充分利用太阳能,进行海水淡化 | |
| B. | 将秸秆露天焚烧,从而充分利用生物质能 | |
| C. | 以二氧化硅为光电池材料,将太阳能转化为电能 | |
| D. | 用甲烷与水作用生产清洁能源--H2,该过程的原子利用率为100% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12 | B. | 11 | C. | 4 | D. | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z与Y、Z与W形成的化合物的化学键完全相同 | |
| B. | X与Y组成的简单氢化物的沸点高于X与R组成的简单氢化物的沸点,是因为非金属性Y>R | |
| C. | 简单离子的半径:Z>R>W>Y | |
| D. | Y、Z、W三种元素组成的化合物的水溶液可能显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF比H2O稳定性更强,是由于HF分子间作用力较大 | |
| B. | CC14、N2和SiO2晶体中,各原子最外层都达到8电子稳定结构 | |
| C. | Na投入到水中,有共价键的断裂与形成 | |
| D. | 离子化合物中一定含有离子键,可能含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过量 Cl2:Fe2+、H+、Al3+、Cl-、SO42- | |
| B. | 过量SO2:Fe2+、H+、Al3+、SO42- | |
| C. | 过量氨水:NH4+、AlO2-、SO42-、OH- | |
| D. | 过量 Na2O2:Na+、Fe3+、SO42-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用硫酸清洗锅炉中的水垢 | |
| B. | Na2O2 用作呼吸面具的供氧剂 | |
| C. | 氯水中通入SO2 后溶液的酸性减弱 | |
| D. | N2 与O2 在放电条件下直接化合生成NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu(NO3)2 | B. | HCl | C. | MgCl2 | D. | Na2SO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com