
| A、加入KSCN溶液一定不变红色 |
| B、溶液中一定含Fe2+ |
| C、剩余固体中一定含Cu |
| D、溶液中一定含Cu2+ |


科目:高中化学 来源: 题型:
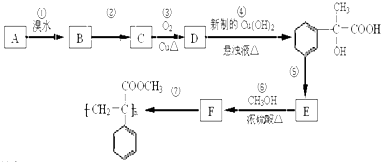
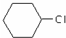 为原料合成重要的化工产品
为原料合成重要的化工产品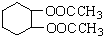 ,写出相应的合成路线流程图(无机试剂任用)
,写出相应的合成路线流程图(无机试剂任用)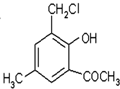 的同分异构体的结构简式:
的同分异构体的结构简式:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、Al3+、Cl-、CO32- |
| B、H+、Na+、Br-、SiO32- |
| C、Na+、Fe2+、SO42-、NO3- |
| D、K+、NH4+、OH-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 弱电解质 | H2CO3 | NH3?H2O |
| 电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | 1.77×10-5 |
| A、c (NH4+)>c (CO32-)>c (NH3?H2O)>c (HCO3-) |
| B、c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+2 c(CO32-) |
| C、c (CO32-)+c (HCO3-)+c (H2CO3)=0.1 mol?L-1 |
| D、c (NH4+)+c (NH3?H2O)=2 c (CO32-)+2c (HCO3-)+2 c (H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、通过向明矾溶液中加入足量的NaOH溶液,来制备Al(OH)3 |
| B、通过加入澄清石灰水,鉴别Na2CO3溶液和NaHCO3溶液 |
| C、可以通焰色反应的颜色不同来区别FeCl3溶液和FeCl2溶液 |
| D、只需加入足量的NaOH溶液,再过滤,就能除去Fe2O3中的Al2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH>7,且c(OH-)>c(Na+)>c(H+)>c(CH3COO-) |
| B、pH>7,且c(Na+)+c(H+)=c(OH-)+c(CH3COO-) |
| C、pH<7,且c(CH3COO-)>c(H+)>c(Na+)>c(OH-) |
| D、pH=7,且c(CH3COO-)=c(Na+)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 蛇纹石可用于生产氢氧化镁,简要工艺流程如下:
蛇纹石可用于生产氢氧化镁,简要工艺流程如下:| Fe3+ | Al3+ | Fe2+ | Mg2+ | |
| 开始沉淀 | 1.5 | 3.3 | 6.5 | 9.4 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| n(SO32-):n(HSO3-) | 91:9 | 1:l | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
| 催化剂 |
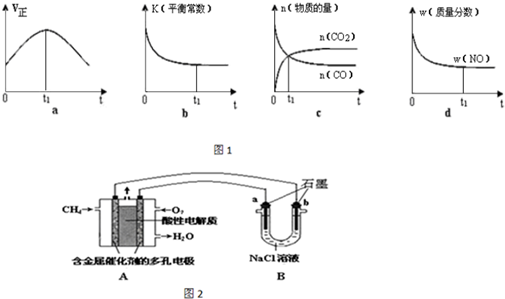
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com