
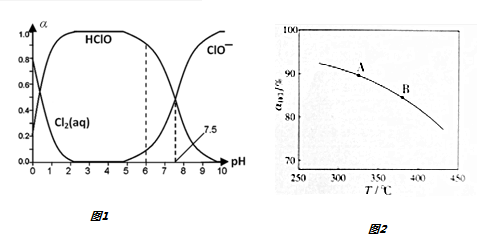
分析 (1)①上述体系中属于电离平衡的是HClO?H++ClO-,据图表数据计算;
②任何电解质溶液中都存在电荷守恒,据电荷守恒分析;
(2)根据盖斯定律,①×$\frac{1}{2}$+③-②×$\frac{1}{2}$可得:H2O2(l)+Cl2(g)=2HCl(g)+O2(g),反应热也进行相应的计算,进而书写热化学方程式;
(3)①由图可知,温度越高,平衡时HCl的转化率越小,说明升高温度平衡向逆反应方向移动;
②正反应为气体体积减小的反应,增大压强,平衡向正反应方向移动,相同温度下HCl的平衡转化率比之前实验的大;
③改变措施有利于提高αHCl,应使平衡向正反应方向移动,注意不能只增加HCl的浓度;
(4)沉淀后溶液中剩余氢离子浓度,计算pH,根据溶液中c(Ag+)•c(Cl-)与Ksp的大小关系分析.
解答 解:(1)①上述体系中属于电离平衡的是HClO?H++ClO-,其平衡常数表达式为:K=$\frac{[{H}^{+}][Cl{O}^{-}]}{[HClO]}$,在pH=7.5时,c(ClO-)与c(HClO)相等,K=c(H+)=10-7.5,
故答案为:10-7.5;
②体系中存在电荷守恒c(H+)=c(Cl-)+c(ClO-)+c(OH-),即c(Cl-)+c(ClO-)=c(H+)-c(OH-),在氯水中HCl完全电离、HClO部分电离,所以c(HClO)<c(Cl-),所以c(HClO)+c(ClO-)<c(H+)-c(OH-),故答案为:小于;
(2)发生反应:H2O2(l)+Cl2(g)=2HCl(g)+O2(g),
已知:①2H2O2(l)═2H2O(l)+O2(g)△H1=-196.46kJ•mol-1
②2H2(g)+O2(g)═2H2O(l)△H2=-571.6KJ/mol
③Cl2(g)+H2(g)═2HCl(g)△H3=-184.60kJ•mol-1
根据盖斯定律,①×$\frac{1}{2}$+③-②×$\frac{1}{2}$可得:H2O2(l)+Cl2(g)=2HCl(g)+O2(g),△H=(-196.46kJ•mol-1)×$\frac{1}{2}$+(-184.60kJ•mol-1)-$\frac{1}{2}$×(-571.6kJ•mol-1)=+3.01kJ•mol-1,故热化学方程式为:H2O2(l)+Cl2(g)=2HCl(g)+O2(g)△H=+3.01 kJ/mol,
故答案为:H2O2(l)+Cl2(g)=2HCl(g)+O2(g)△H=+3.01 kJ/mol;
(3)①由图可知,温度越高,平衡时HCl的转化率越小,说明升高温度平衡向逆反应方向移动,则正反应为放热反应,即△H<0,化学平衡常数减小,即K(A)>K(B),
故答案为:<;K(A);
②正反应为气体体积减小的反应,
A.增大n(HCl),HCl浓度增大,平衡右移,但HCl的转化率降低,故A错误;
B.增大n(O2),氧气浓度增大,平衡右移,HCl的转化率提高,故B正确;
C.使用更好的催化剂,加快反应速率,缩短到达平衡的时间,不影响平衡移动,HCl的转化率不变,故C错误;
D.移去生成物H2O,有利于平衡右移,HCl的转化率增大,故D正确,
故选:BD;
(4)沉淀生成后,氢离子浓度c=$\frac{0.02mol/L}{2}$=0.01mol/L,所以pH=2,
向沉淀生成后的溶液中再加入50mL0.001mol/L的盐酸,则溶液体积为0.15L,
c(Ag+)=$\frac{1.0×1{0}^{-7}×0.1}{0.15}$=$\frac{2}{3}$×10-7mol/L,
c(Cl-)=0.001mol/L,
则c(Ag+)•c(Cl-)=$\frac{2}{3}$×10-7×0.001=×10-10<Ksp=1.0×10-10,所以不产生沉淀,不能观察到现象,
故答案为:2,不能.
点评 本题考查了氧化还原反应中氧化剂还原剂判断及计算、离子方程式书写、化学平衡常数及计算、热化学方程式书写、化学平衡及平衡常数影响因素、化学反应速率的计算等,题目难度较大,较好的考查的分析解决问题的能力.


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在饱和氯水中:Cl-、NO3-、Na+、SO32- | |
| B. | 0.1mol/L NaAlO2溶液中:K+、CO32-、SO42-、Cl- | |
| C. | 在强碱性溶液中:Na+、NH4+、SO32-、Cl- | |
| D. | 1.0mol•L-1的盐酸溶液中:K+、Fe2+、ClO-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{77}^{192}$Ir和${\;}_{77}^{193}$Ir是两种核素 | |
| B. | ${\;}_{77}^{192}$Ir和${\;}_{77}^{193}$Ir是两种元素 | |
| C. | Ir是主族元素 | |
| D. | 由${\;}_{77}^{193}$Ir经过中子辐射后获得${\;}_{77}^{192}$Ir是化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NH4+,NO3-,CO32-,Na+ | B. | Na+,Ba2+,Mg2+,HCO3- | ||
| C. | NO3-,Ca2+,K+,H+ | D. | NO3-,K+,AlO2-,OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ③④⑥ | C. | ②④⑥ | D. | ④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaCl2→Na2CO3 | B. | Na2CO3→HCl | C. | Na2CO3→Ca(OH)2 | D. | 水→BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 流程中涉及过滤、萃取、蒸馏等操作 | |
| B. | 反应②产生的阴离子主要为CO${\;}_{3}^{2-}$ | |
| C. | 反应③属于复分解反应 | |
| D. | 反应①②为离子反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com