
| A. | 常温下硫的氧化物都是气体,通入水中都形成强酸 | |
| B. | 将FeCl3滴入饱和H2S溶液中,溶液的pH降低 | |
| C. | 将CO2通入CaSO4溶液中,无明显现象 | |
| D. | 充分利用含硫矿物,既可实现资源的有效利用,还可减轻酸雨污染 |
分析 A.硫的氧化物有二氧化硫、三氧化硫和水反应生成的酸为亚硫酸、硫酸;
B.将FeCl3滴入饱和H2S溶液中发生氧化还原反应生成硫单质、盐酸;
C.碳上酸性弱于硫酸,将CO2通入CaSO4溶液中不发生反应;
D.充分利用含硫矿物减少二氧化硫排放.
解答 解:A.硫的氧化物有二氧化硫、三氧化硫和水反应生成的酸为亚硫酸、硫酸,亚硫酸为弱酸,硫酸为强酸,故A错误;
B.将FeCl3滴入饱和H2S溶液中发生氧化还原反应生成硫单质、盐酸,2Fe3++H2S=S+2Fe2++2H+,故B正确;
C.碳上酸性弱于硫酸,将CO2通入CaSO4溶液中不发生反应,混合后溶液无明显现象,故C正确;
D.充分利用含硫矿物减少二氧化硫排放,既可实现资源的有效利用,还可减轻酸雨污染,故D正确;
故选A.
点评 本题考查了物质性质的应用、物质性质和反应产物判断,注意知识的积累,题目难度不大.


科目:高中化学 来源: 题型:解答题
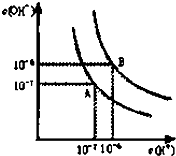 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -5.56×104 kJ•mol-1 | B. | 5.56×104 kJ•mol-1 | ||
| C. | 5.56×104 kJ | D. | -5.56×104 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
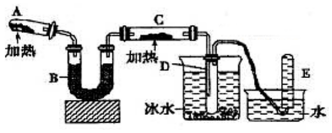 己知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应.
己知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用pH计测定0.1mol/L氨水的pH | |
| B. | 用pH试纸测定0.1mol/LNH4Cl溶液的pH | |
| C. | 将氨水连接在一个带灯泡的通电电路中,观察灯泡亮度 | |
| D. | 等浓度、等体积的氨水和NaOH分别与等浓度的盐酸反应,比较消耗盐酸体积的多少 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
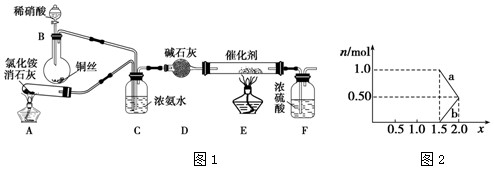
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ①③④ | D. | ①②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com