
 _�� 9.8g H2SO4�����ʵ�����______mol�� ______g����Ԫ�أ�______g��SO42-��
_�� 9.8g H2SO4�����ʵ�����______mol�� ______g����Ԫ�أ�______g��SO42-��| A�����ʵ���______________ | B�����___________________ |
| C������__________________ | D����ԭ����_______________ |
 �����ܿ����ϵ�д�
�����ܿ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
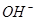 ��ĿΪ0��2NA
��ĿΪ0��2NA| A���٢ۢݢ� | B���ۢݢޢ� | C���ڢܢޢ� | D���ۢܢݢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��2Na2O2 + 2CO2 |
| B��Na2O2 + MnO2 = Na2MnO4 |
C��5Na2O2 + 2MnO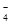 + 16H+ = 10Na+ + 2Mn2+ + 5O2�� + 8H2O + 16H+ = 10Na+ + 2Mn2+ + 5O2�� + 8H2O |
| D��2Na2O2 + 2H2SO4 = 2Na2SO4 +2H2O + O2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�������ǽ�״�Ĵ��������� |
| B������ı������������ɢ������ֱ��Ϊ1��100nm |
| C�����ö����ЧӦ��������Һ�ͽ��� |
| D��������FeCl3��Һ�����ˮ�У�����п��γɺ��ɫ�Ľ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��100 mL 0.5 mol��L MgCl2��Һ | B��200 mL 0.25 mol��L HCl��Һ |
| C��50 mL 1 mol��L NaCl��Һ | D��200 mL 0.25 mol��L CaCl2��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��26.3 | B��13.2 | C��24 | D��12 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
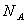 Ϊ�����ӵ����������������������
Ϊ�����ӵ����������������������A��18g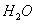 �к��е�������Ϊ10 �к��е�������Ϊ10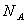 |
B��12g���ʯ�к��еĹ��ۼ���Ϊ4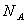 |
C��46g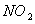 �� ��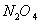 ��������к���ԭ������Ϊ3 ��������к���ԭ������Ϊ3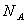 |
D��1molNa������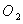 ��Ӧ������ ��Ӧ������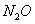 �� ��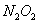 �Ļ�����ʧȥ �Ļ�����ʧȥ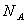 ������ ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����Cu��Zn��ϡ������ɵ�ԭ��ع���ʱ����Cu������0��2gH2�����·ͨ������0��4NA |
| B��18 g D2O�к��е�������ĿΪ10NA |
| C��1 mol Cl2������Ӧʱ��ת�Ƶĵ�����һ����2 NA |
| D�����³�ѹ�£�16 g O3������ԭ����ΪNA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 �������ӣ����ֻȡһ�θ���Һ���ֱ��������Լ����������Ӽ��������Ҫ��ÿ����һ���Լ��ܹ������һ�����ӣ������������Լ���Ϊ������������Լ����Ⱥ�˳��Ϊ��д��ѧʽ����__________��__________��____________��
�������ӣ����ֻȡһ�θ���Һ���ֱ��������Լ����������Ӽ��������Ҫ��ÿ����һ���Լ��ܹ������һ�����ӣ������������Լ���Ϊ������������Լ����Ⱥ�˳��Ϊ��д��ѧʽ����__________��__________��____________���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com