
| A、还原性:F-<Cl-<Br-<I- |
| B、微粒半径:F->Na+>Mg2+>Al3+ |
| C、酸性HClO4>HClO3>HClO2>HClO |
| D、热稳定性:NH3<H2O<HF<HCl |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 ④
④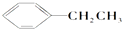
| A、② | B、③④ | C、①③ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 N2(g)+3H2(g)═2NH3(g)+92.4kJ.恒容时,体系中各物质浓度随时间变化的曲线如图示.下列说法错误的是( )
N2(g)+3H2(g)═2NH3(g)+92.4kJ.恒容时,体系中各物质浓度随时间变化的曲线如图示.下列说法错误的是( )| A、前20分钟反应内放出的热量为46.2kJ |
| B、第25分钟改变的条件是将NH3从反应体系中分离出去 |
| C、若第60分钟时反应又达到了平衡,则时段Ⅲ改变的条件是增大压强 |
| D、时段Ⅰ仅将初始投放的物质浓度增至原来的2倍,则反应物的转化率增大,平衡常数不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、足量的Cu与含硫酸2mol的浓硫酸反应产生NA个SO2分子 |
| B、1mol O2在反应中作氧化剂时所得电子数一定为4NA个 |
| C、1molHCl气体中的粒子数与0.5mol/L盐酸中溶质粒子数均为NA个 |
| D、常温下,1L 1mol/L Na2CO3溶液中所含的碳原子数为NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ |
| B、铁片投入到稀硫酸中:Fe+2H+═Fe2++H2↑ |
| C、碳酸钙加入过量盐酸中:CO32-+2H+=CO2↑+H2O |
| D、一小块钠投入到水中:Na+2H2O=Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电子从原电池的负极通过导线移动向正极 |
| B、电子从原电池的正极通过导线移动向负极 |
| C、阴离子在电解质溶液中向正极移动 |
| D、阳离子在电解质溶液中向负极移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com