
【题目】高纯度氧化铝有广泛的用途,某研究小组研究用以下流程制取高纯度氧化铝: 
根据上述流程图填空:
(1)“除杂”操作是加入过氧化氢后,用氨水调节溶液的pH约为8.0,以除去硫酸铵溶液中的少量Fe2+ . 请写出在除去Fe2+离子的过程中,发生的主要反应的离子方程式 .
(2)通常条件下Ksp〔Fe(OH)3〕=4.0×10﹣38 , 除杂后溶液中c(Fe3+)约为 .
(3)配制硫酸铝溶液时,需用硫酸酸化,酸化的目的是 .
(4)“结晶”这步操作中,母液经蒸发浓缩至溶液表面刚出现薄层晶体即停止加热,然后冷却结晶,得到铵明矾晶体(含结晶水).母液不能蒸干的原因是 .
(5)“分离”操作的名称是 (填字母代号).
A.蒸馏
B.分液
C.过滤
(6)铵明矾晶体的化学式为NH4Al(SO4)212H2O,在0.1mol/L铵明矾的水溶液中,离子浓度最大的离子是 , 离子浓度最小的离子是 .
【答案】
(1)2Fe2++H2O2+4NH3?H2O=2Fe(OH)3↓+4NH4+
(2)4×10﹣20mol/L
(3)抑制Al3+水解
(4)减少可溶性杂质的析出及Al3+水解
(5)C
(6)SO42﹣;OH﹣
【解析】解:(1.)亚铁离子具有还原性,双氧水具有强氧化性,在碱性溶液中,亚铁离子被氧化生成铁离子,铁离子与氢氧根结合生成氢氧化铁沉淀,此反应的离子反应方程式为:2Fe2++H2O2+4NH3H2O=2Fe(OH)3↓+4NH4+ , 故答案为:2Fe2++H2O2+4NH3H2O=2Fe(OH)3↓+4NH4+;
(2.)KSP[Fe(OH)3]=4.0×10﹣38 , PH=8,溶液中氢氧根离子浓度为:1×10﹣6mol/L,c(Fe3+)= ![]() mol/L=4.0×10﹣20mol/L,故答案为:4.0×10﹣20mol/L;
mol/L=4.0×10﹣20mol/L,故答案为:4.0×10﹣20mol/L;
(3.)由于铝离子在溶液中能够发生水解生成氢氧化铝,所以加入硫酸酸化,抑制了铝离子的水解,故答案为:抑制Al3+水解;
(4.)由于蒸干会析出可溶性杂质的析出,且Al3+水解程度增大,所以母液不能蒸干,故答案为:减少可溶性杂质的析出及Al3+水解;
(5.)通过过滤,将硫酸铝晶体从溶液中分离,所以C正确;故选C;
(6.)铵明矾晶体的化学式为NH4Al(SO4)212H2O,在0.1mol/L铵明矾的水溶液中,未水解前,c(Al3+)=c(NH4+)=0.1mol/L,由于铵根和铝离子均水解,水解结合水电离出的氢氧根,故水解后浓度均小于0.1mol/L,c(SO42﹣)=0.2mol/L,0.2>0.1,故答案为:SO42﹣;OH﹣ .
(1)H2O2溶液具有强氧化性,可以氧化亚铁离子生成铁离子,铁离子在氨水存在的条件下生成氢氧化铁红褐色沉淀;(2)根据氢氧化铁的溶度积及PH=8计算出铁离子浓度;(3)铝离子在溶液中能够发生水解生成氢氧化铝;(4)蒸干会析出可溶性杂质的析出,且Al3+水解程度增大;(5)将晶体与溶液分离的操作是过滤;(6)根据题中所给的化学式,利用铵根和铝离子水解进行解答即可.


科目:高中化学 来源: 题型:
【题目】有关物质用途的说法错误的是
A. 淀粉可用作酿酒的原料
B. 油脂可用作制肥皂的原料
C. 乙烯可用作水果的催熟剂
D. 95%(体积分数)的乙醇可直接用作医疗消毒剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,分别以高锰酸钾、氯酸钾、过氧化氢(H2O2)为原料制取氧气,当制得同温、同压下相同体积的O2时,三个反应中转移的电子数之比为 ( )
A.1∶1∶1B.4∶3∶2C.2∶3∶1D.2∶2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D均为中学所学的常见物质且均含有同一种元素,它们之间的转化关系如图所示(反应条件及其他物质已经略去):
A ![]() B
B ![]() C
C ![]() D
D
(1)若A是黄色晶体;B为酸雨的成因之一,且可使品红溶液褪色,则将B通入KMnO4溶液的现象为:;体现B的(填“氧化性”“还原性”“漂白性”);
请写出D的浓溶液与单质铜反应的化学方程式:;此反应中作氧化剂的D与参加反应的D的物质的量之比为:;
(2)若A气体可使湿润的红色石蕊试纸变蓝,常温下D的浓溶液能使金属Fe、Al钝化,请写出实验室制备A的化学方程式:请写出C→D的离子方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素原子半径与原子序数的关系图。则下列说法正确的是( )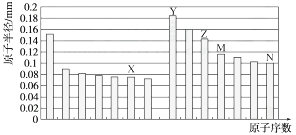
A.Z、N两种元素的离子半径相比,前者较大
B.X、N两种元素的气态氢化物的沸点相比,前者较低
C.由X与M两种元素组成的化合物不能与任何酸反应,但能与强碱反应
D.Z的氧化物能分别溶解于Y的氢氧化物和N的氢化物的水溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl为白色晶体,微溶于水,不溶于稀酸和醇,易水解,在空气中易氧化成Cu2(OH)3Cl.实验室以铜灰(主要成分为CuO,其含量约为70%)制备CuCl的流程如下: 
制备流程中,“水解”中发生的反应为:Na[CuCl2]=CuCl↓+NaCl.
(1)“反应”中,发生的化学方程式为 , 加入稍过量的盐酸作用有、 .
(2)“洗涤”中,先用稀盐酸洗涤数次后用酒精漂洗,用酒精漂洗的目的是 .
(3)“过滤”、“洗涤”和“干燥”都必须在真空密闭的环境中进行,否则会发生反应的化学方程式为 .
(4)流程工艺中,水解后的滤液经过后期处理,可回收(填化学式)以循环使用.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项表述中正确的是( )
A.Na2O中的Na+和O2-的核外电子排布不相同
B.106g的乙醇和丙醇混合液完全燃烧生成的CO2为112L(标准状况)
C.在氮原子中,质子数为7而中子数不一定为7
D.Cl-的结构示意图为 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com