
| A. |  用于制氨气并收集干燥的氨气 | |
| B. | 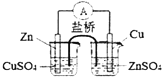 是实现化学能转化为电能的铜锌原电池的原理示意图 | |
| C. | 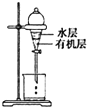 是用CCl4提取碘水中的I2 | |
| D. |  用于配制100mL0.2mo1•L-1的硫酸溶液 |
分析 A.实验室可用氢氧化钙和氯化铵在加热条件下制备氨气,氨气密度比空气小,可用碱石灰干燥;
B.锌应插入硫酸锌溶液中;
C.分液时,分液漏斗下端紧贴烧杯;
D.不能在容量瓶中直接稀释浓硫酸.
解答 解:A.实验室可用氢氧化钙和氯化铵在加热条件下制备氨气,氨气密度比空气小,易溶于水,可形成喷泉,可用碱石灰干燥,可完成实验,故A正确;
B.形成原电池反应时,锌应插入硫酸锌溶液中,否则锌置换出铜,不能形成电流,故B错误;
C.分液时,分液漏斗下端紧贴烧杯,防止液体飞溅,故C错误;
D.容量瓶只能用于配制一定浓度的溶液,且只能在常温下使用,不能在容量瓶中直接稀释浓硫酸,故D错误.
故选A.
点评 本题考查化学实验方案的评价,为高频考点,涉及气体的制备、物质的分离以及原电池知识等,把握实验原理及实验装置图的作用为解答的关键,注意方案的合理性、操作性分析,题目难度不大.


科目:高中化学 来源: 题型:解答题
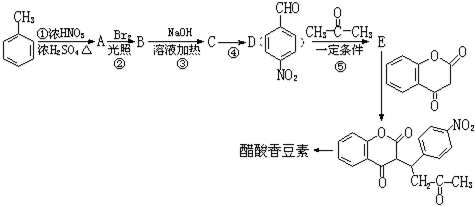

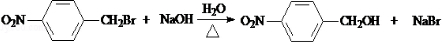 .
.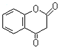 互为同分异构体且同时符合下列条件的有机物的结构简式为
互为同分异构体且同时符合下列条件的有机物的结构简式为
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,饱和CaCO3溶液与饱和CaF2溶液等体积混合,不会析出CaF2固体 | |
| B. | 25℃时,饱和CaCO3溶液与饱和CaF2溶液相比,前者Ca2+浓度大 | |
| C. | 25℃时,在CaCO3悬浊液中加人NaF固体,CaCO3全部溶解 | |
| D. | 25℃时,CaCO3固体在盐酸中的Ksp比在氨水中的Ksp大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 用装置A完成SiCl4的制备 | |
| B. | 用装置B进行蒸馏提纯SiCl4 | |
| C. | 用装置C进行滴定达终点时现象是:锥形瓶内溶液变为紫红色且半分钟内不变色 | |
| D. | 配制0.1 mol•L-1KMnO4溶液定容摇匀后,发现液面低于刻度线,加水至刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 信息产业中光纤的主要成分是单质硅 | |
| B. | 碳酸氢钠可用于制备纯碱,作治疗胃酸过多的药物及食品发酵剂 | |
| C. | 高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强 | |
| D. | 医学上,血液透析是利用了胶体的渗析原理 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在一定条件下,0.2 mol SO2和0.1 mol O2充分反应,生成SO3的分子数为0.2 NA | |
| B. | 1 L 0.1 mol/L的Na2CO3溶液中阴离子的个数是0.1 NA | |
| C. | 常温常压下,2.24 L 氯气与过量的氢氧化钠溶液完全反应转移的电子数为0.1 NA | |
| D. | 常温常压下,2 g D2O含有的质子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
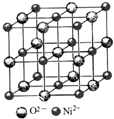 高氯酸三碳酰肼合镍{[Ni(CHZ)3](ClO4)2 }是一种新型的起爆药.
高氯酸三碳酰肼合镍{[Ni(CHZ)3](ClO4)2 }是一种新型的起爆药.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 实验室用图所示装置电解氯化铜溶液,实验中观察到碳(I)电极质量增加,碳(II)电极有气体放出.下列说法正确的是( )
实验室用图所示装置电解氯化铜溶液,实验中观察到碳(I)电极质量增加,碳(II)电极有气体放出.下列说法正确的是( )| A. | a为电源正极 | B. | 电极Ⅱ上发生还原反应 | ||
| C. | 电子流向:a→Ⅰ→Ⅱ→b | D. | 该装置将电能转化为化学能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com