
| A、氨气分子是极性分子而甲烷是非极性分子 |
| B、NH3分子中有一对未成键的弧对电子,它对成键电子的排斥作用较强 |
| C、NH3为分子中N原子形成3个杂化轨道,CH4中C原子形成4个杂化轨道 |
| D、两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化 |
| 1 |
| 2 |
| 1 |
| 2 |


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
| A、NaOH溶液中滴入酚酞试液,溶液呈无色 |
| B、品红溶液中通入SO2气体,溶液呈紫色 |
| C、FeCl3溶液中滴入KSCN溶液,溶液呈蓝色 |
| D、新制Cu(OH)2悬浊液中加入葡萄糖溶液并加热,产生砖红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al与冷的浓H2SO4:2Al+12H++3SO42-═2Al3++3SO2+6H2O |
| B、氨水与盐酸反应:H++OH-═H2O |
| C、Fe与FeCl3溶液:Fe+Fe3+═2Fe2+ |
| D、少量Al Cl3溶液滴入NaOH溶液中:Al3++4OH-═「Al(OH)4」- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 编号 |
HA物质的量 | NaOH物质的量 | 混合溶液 |
| 浓度(mol?L-1) | 浓度(mol?L-1) | 的pH | |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
| c(H3O+)c(OH-) |
| c(H2O) |
| c(H3O+)c(O2-) |
| c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
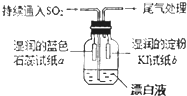 SiO2、SO2、NaOH、H2O、卤素及其化合物是中学化学中的常见物质,他们在生产、生活中有着广泛的应用,请回答下列有关问题:
SiO2、SO2、NaOH、H2O、卤素及其化合物是中学化学中的常见物质,他们在生产、生活中有着广泛的应用,请回答下列有关问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| CuO | CO | Cu | CO2 |
| 0.8mol | 0.4mol | 0.6mol | 0.6mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com