
【题目】已知下列反应:
① 2C(s)+O2(g)=2CO(g) △H1 = –221 kJ/mol
② CO(g)+1/2O2(g)=CO2 (g) △H2 = –283 kJ/mol
③ 稀溶液中:H+(aq)+OH-(aq)=H2O(l) △H3 = –57.3 kJ/mol
请回答下列问题:
(1)碳(C)的燃烧热为_______________________ 。已知碳的两种同素异形体的转化如下:C(s,金刚石) = C(s,石墨) △H = –1.9 kJ/mol ,则从能量角度判断:稳定性更大的是_________________(填名称)
(2)写出能表达反应③意义的一个热化学方程式_________________________________________________,向2L 0.5mol/L的NaOH溶液中加入稀醋酸,恰好完全反应时的热效应为△H4 ,则△H3_________△H4(填“>”,“=”或“<”)
【答案】393.5kJ/mol 石墨 HCl(aq)+NaOH(aq)=H2O(l)+NaCl(aq) △H= –57.3 kJ/mol △H3 < △H4
【解析】
(1)根据盖斯定律将①![]() +②可得碳燃烧热的热化学方程式,从而可以知道其燃烧热;物质具有能量越高,物质的稳定性越弱;
+②可得碳燃烧热的热化学方程式,从而可以知道其燃烧热;物质具有能量越高,物质的稳定性越弱;
(2)反应③为稀的强酸溶液与稀的强碱溶液反应生成盐和水的反应;醋酸为弱酸,电离过程需要吸收热量,导致放热热量减少,结合焓变为负值判断。
(1) ① 2C(s)+O2(g)=2CO(g) △H1 = –221 kJ/mol
② CO(g)+1/2O2(g)=CO2 (g) △H2 = –283 kJ/mol
根据盖斯定律①![]() +②可得:C(s)+O2(g)= CO2 (g) △H= –393.5 kJ/mol;
+②可得:C(s)+O2(g)= CO2 (g) △H= –393.5 kJ/mol;
根据反应C(s,金刚石) = C(s,石墨) △H = –1.9 kJ/mol ,可以知道,该反应为放热反应,说明金刚石的能量高于石墨,则石墨的稳定性更大,
因此,本题正确答案是:393.5kJ/mol;石墨;
(2)稀溶液中H+(aq)+OH-(aq)=H2O(l) △H3 = –57.3 kJ/mol
表示稀的强酸与稀的强碱溶液反应的热化学方程式,如热化学方程式:HCl(aq)+NaOH(aq)=H2O(l)+NaCl(aq) △H= –57.3 kJ/mol;
稀醋酸与氢氧化钠稀溶液恰好反应的中和热为△H4,因为醋酸的电离吸热,则反应中放出热量减少,因为焓变为负值,则△H3>△H4,
因此,本题正确答案是:HCl(aq)+NaOH(aq)=H2O(l)+NaCl(aq) △H= –57.3 kJ/mol;△H3 < △H4。


科目:高中化学 来源: 题型:
【题目】下列热化学方程式及有关应用的叙述中,正确的是
A. 甲烷的燃烧热为890.3kJmol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+ 2O2(g) ═ CO2(g) + 2H2O(g) △H = -890.3kJmol-1
B. 已知强酸与强碱在稀溶液里反应的中和热为57.3kJmol-1,则1/2H2SO4(aq)+1/2Ba(OH)2(aq)═1/2BaSO4(s)+H2O(l) △H = -57.3kJmol-1
C. 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g) + 3H2(g)![]() 2NH3(g) △H = -38.6kJmol-1
2NH3(g) △H = -38.6kJmol-1
D. 已知25℃、101KPa条件下:4Al(s) + 3O2(g) ═ 2A12O3(s) △H = -2834.9kJmol-1,4Al(s) + 2O3(g) ═ 2A12O3(s) △H = -3119.1kJmol-1,则O2比O3稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一恒温、恒容的密闭容器中发生反应A(s)+2B(g)![]() C(g)+D(g),当下列物理量不再变化时,不能够表明该反应已达平衡状态的是
C(g)+D(g),当下列物理量不再变化时,不能够表明该反应已达平衡状态的是
A.混合气体的压强B.混合气体的平均相对分子质量
C.A的物质的量D.B的物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关图示的分析中,不正确的是

A.如果该图为组成活细胞中的元素,则A是氧元素
B.如果该图表示的是组成细胞的化合物,则A是蛋白质
C.如果该图表示的是活细胞中的元素,则其中Mo的含量很少
D.如果该图为组成细胞的有机化合物,则A中肯定含有的元素为C、H、O、N
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组以 H2O2 分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响,在常温下按照如下方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10 mL 2% H2O2 溶液 | 无 |
② | 10 mL 5% H2O2 溶液 | 无 |
③ | 10 mL 5% H2O2 溶液 | 1 mL 0.1 mol L-1 FeCl3 溶液 |
④ | 10 mL 5% H2O2 溶液+少量 HCl 溶液 | 1 mL 0.1 mol L-1 FeCl3 溶液 |
⑤ | 10 mL 5% H2O2 溶液+少量 NaOH溶液 | 1 mL 0.1 mol L-1 FeCl3 溶液 |
(1)催化剂能加快化学反应速率的原因是_____。
(2)实验①和②的目的是_________。实验时由于较长时间没有观察到明显现象而无法得出结论。资料显示,通常条件下 H2O2 稳定,不易分解。为了达到实验目的,你对原实验方案的改进是_____。
(3)写出实验③的化学反应方程式:_____。
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图。分析如图能够得出的实验结论是_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二硫代碳酸钠(Na2CS3)在农业上用作杀菌剂和杀线虫剂,在工业上用于处理废水中的重金属离子。某化学兴趣小组对Na2CS3的一些性质进行探究。回答下列问题:
(1)在试管中加入少量三硫代碳酸钠样品,加水溶解,所得溶液pH=10,由此可知H2CS3是____酸(填“强”或“弱”)。向该溶液中滴加酸性KMnO4溶液,紫色褪去,由此说明Na2CS3具有____性。
(2)为了测定某Na2CS3溶液的浓度,按图装置进行实验。将35.0 mLNa2CS3溶液置于下列装置A的三颈瓶中,打开仪器d的活塞,滴入足量2.0 mol/L稀H2SO4,关闭活塞。

已知:![]() CS2和H2S均有毒:CS2不溶于水,沸点46℃,与C02某些性质相似,与NaOH作用生成Na2COS2和H2O。
CS2和H2S均有毒:CS2不溶于水,沸点46℃,与C02某些性质相似,与NaOH作用生成Na2COS2和H2O。
①仪器d的名称是____。反应开始时需要先通入一段时间N2,其作用为____。
②B中发生反应的离子方程式是____。
③反应结束后打开活塞k,再缓慢通入热N2 一段时间,其目的是____。
④为了计算三硫代碳酸铀溶液的浓度,可测定B中生成沉淀的质量。称量B中沉淀质量之前需要进行的实验操作名称是____,若B中生成沉淀的质量为8.4g则35.0 mL三硫代碳酸钠溶液的物质的量浓度是____。
⑤若反应结束后将通热N2改为通热空气,通过测定C中溶液质量的增加值来计算三硫代碳酸钠溶液的浓度时,计算值____<填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在容积固定的某密闭容器中发生的反应N2+3H2![]() 2NH3在10s内N2的浓度由5molL-1降至4molL-l。下列说法正确的是
2NH3在10s内N2的浓度由5molL-1降至4molL-l。下列说法正确的是
A.充分反应后,N2、H2中至少有一种物质浓度可降为零
B.使用合适的催化剂,可以加快该反应的速率
C.增加H2的浓度或降低温度都会加快该反应的速率
D.用NH3表示的化学反应速率为0.1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G是一种广谱镇痛药,在实验室中合成路线如下(部分反应条件和产物已略去)

(1)A的名称为___________(用系统命名法命名)
(2)由B生成C及由C生成D的反应类型分别为___________、___________。
(3)E的结构简式为______________________。
(4)写出F与NaOH溶液反应的化学方程式_________________________________。
(5)R是G的同分异构体,已知R能与碳酸氢钠溶液反应放出二氧化碳,苯环上有三个取代基,核磁共振氢谱中峰的面积之比为12:2:2:1:1,写出符合条件的两种R的结构简式____________________________________________。
(6)参照上述合成路线,以苯、甲醇和乳酸(![]() )为原料设计合成
)为原料设计合成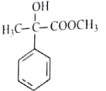 (其它无机试剂任选)。_____________________________________
(其它无机试剂任选)。_____________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们应用原电池原理制作了多种电池,以满足不同的需要。以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息填空。
(1)蓄电池在放电时起原电池作用,在充电时起电解池的作用。铅蓄电池在放电时发生的电池反应式为:Pb+PbO2+2H2SO4=2PbSO4+2H2O。负极反应式为________________反应一段时间后负极的质量_________(填“增重”或“减少”或“不变”)
(2)燃料电池是一种高效、环境友好的供电装置,如图是甲烷燃料电池原理示意图,该电池极的负电极反应式是:_____________________;正极电极反应式_______________

(3)将铝片和铜片用导线相连,分别插入浓硝酸中(a组)和插入烧碱溶液中(b组),都形成了原电池,在a组原电池中,负极材料为___________;写出b组插入烧碱溶液中形成原电池的负极反应式:_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com