
 N2O4(g) (无色),如图所示。
N2O4(g) (无色),如图所示。

 2NO2 (g),可知反应中NO2 的物质的量变化较大,则Y表示NO2的物质的量随时间的变化曲线,故答案为:Y;
2NO2 (g),可知反应中NO2 的物质的量变化较大,则Y表示NO2的物质的量随时间的变化曲线,故答案为:Y;
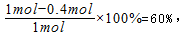


科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.v(H2)=
| B.v(H2)=
| ||||
| C.v(N2)=v(NH3) | D.v(N2)=2v(NH3) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.反应物中一定有气体 | B.生成物中一定有气体 |
| C.正反应一定是放热反应 | D.正反应一定是吸热反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.化学平衡常数是指一定条件下的可逆反应,生成物浓度的幂之积与反应物浓度的幂之积的比值。 |
| B.已知4HCl(g)+O2(g)=2H2O(g)+2Cl2(g) 能自发进行,则该反应ΔH<0,ΔS>0 |
| C.其他条件不变,增大压强,平衡可能移动,但平衡常数一定不变 |
| D.铁制品表面镶锌块和铁制品表面镀锡,都能起到防腐的作用且防腐原理是相同的 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 Fe( s) +CO2(g)的平衡常数K= 0.25。
Fe( s) +CO2(g)的平衡常数K= 0.25。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Fe(OH)2+2H+若在此溶液中加入稀硫酸,则溶液的颜色变化为( )
Fe(OH)2+2H+若在此溶液中加入稀硫酸,则溶液的颜色变化为( )| A.绿色变深 | B.浅绿色变得更浅 | C.变黄 | D.无明显变化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 4NO+6H2O(g),下列叙述不正确的是 ( )
4NO+6H2O(g),下列叙述不正确的是 ( ) | A.达到平衡时,4v(O2)正=5v(NO)逆 |
| B.达到平衡状态后,NH3、O2、NO 、H2O(g)的物质的量保持不变。 |
| C.达到平衡状态时,若增加容器体积,则反应速率增大 |
| D.若单位时间生成xmolNO的同时,生成xmolNH3,则反应达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
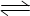 I3-(aq)。在反应的平衡体系中,c(I3-)与温度T的关系如图所示(曲线上的任何一点都表示平衡状态)。
I3-(aq)。在反应的平衡体系中,c(I3-)与温度T的关系如图所示(曲线上的任何一点都表示平衡状态)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com