
����Ŀ�����װ���͡(I)���������Ƽ���Ѫ������ϳ��о�������Ҫ���壬�ϳ�·����ͼ��ʾ��
��֪��i.HC![]() CH+
CH+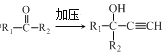
ii.R��NO2![]() R��NH2
R��NH2
iii.R1��NH2+![]() +HCl
+HCl
(1)A�����������_________��
(2)B�Ľṹ��ʽ��________��
(3)D��E�Ļ�ѧ����ʽ��__________��
(4)�Լ�a��_________��
(5)��֪H�ںϳ�I��ͬʱ�������ɼ״���G��H��������L�Ľṹ��ʽ��______��
(6)B��һ��ͬ���칹�����������������ṹ��ʽ��________��
���ܷ���������Ӧ
�ں˴Ź�������ֻ���������շ�
(7)D��E�Ĺ������ж��ָ�����������ڸ߷��ӻ�����Ľṹ��ʽ��_______��
(8)![]() Ҳ�Ǻϳ����װ���͡(I)��һ��ԭ�ϣ��ϳ�·����ͼ��ʾ����������������Ϣ���м����Ľṹ��ʽ��_______________��
Ҳ�Ǻϳ����װ���͡(I)��һ��ԭ�ϣ��ϳ�·����ͼ��ʾ����������������Ϣ���м����Ľṹ��ʽ��_______________��

���𰸡�̼̼���� 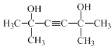
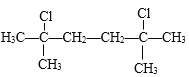 +
+![]()
![]()
 +2HCl ŨHNO3��ŨH2SO4
+2HCl ŨHNO3��ŨH2SO4 ![]()

��������
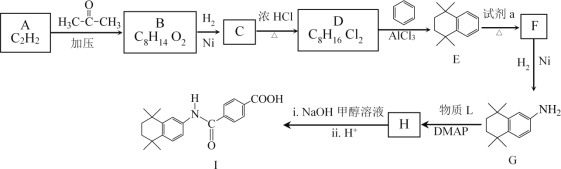
A����ʽ��C2H2��Ϊ��Ȳ���ṹ��ʽΪHC��CH��A��2�����ӵ�![]() ������֪i��Ӧ����B������B����ʽ��֪B�ṹΪ��
������֪i��Ӧ����B������B����ʽ��֪B�ṹΪ�� ��B��H2��Ni�����������·����ӳɷ�Ӧ����C��
��B��H2��Ni�����������·����ӳɷ�Ӧ����C��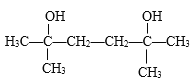 ��C��Ũ������ȣ�����ȡ����Ӧ����D��
��C��Ũ������ȣ�����ȡ����Ӧ����D��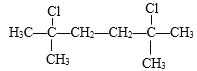 ��D�뱽��AlCl3�����·���ȡ����Ӧ����E��
��D�뱽��AlCl3�����·���ȡ����Ӧ����E�� ����G�Ľṹ��ʽ����֪ii��֪��E��Ũ���ᡢŨ�����ϼ��ȷ���������Ӧ����F��
����G�Ľṹ��ʽ����֪ii��֪��E��Ũ���ᡢŨ�����ϼ��ȷ���������Ӧ����F��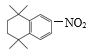 ��F��Ni��Ni���·�����ԭ��Ӧ����G��
��F��Ni��Ni���·�����ԭ��Ӧ����G��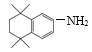 ��G��L��DMAP�����·�Ӧ��֪iii�ķ�Ӧ����H��H��NaOH�״���Һ���ȣ�Ȼ���ữ�õ�I��
��G��L��DMAP�����·�Ӧ��֪iii�ķ�Ӧ����H��H��NaOH�״���Һ���ȣ�Ȼ���ữ�õ�I��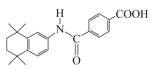 �ͼ״�CH3OH�����ƿ�֪L��
�ͼ״�CH3OH�����ƿ�֪L��![]() ��H��
��H��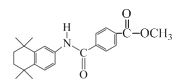 ��Ȼ���������һ�������
��Ȼ���������һ�������
��������������֪��A��HC��CH��B�� ��C��
��C��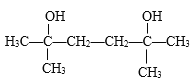 ��D��
��D��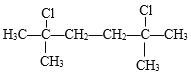 ��E��
��E�� ��F
��F ��G��
��G�� ��L��
��L��![]() ��H��
��H�� ��I��
��I�� ��
��
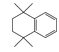
(1)A��HC��CH����A�й�����������̼̼������
(2)��������������֪B�Ľṹ��ʽ�� ��
��
(3)D��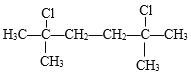 ��D�뱽��AlCl3�����£�������������λ��2��Hԭ�ӵ�ȡ����Ӧ����E��
��D�뱽��AlCl3�����£�������������λ��2��Hԭ�ӵ�ȡ����Ӧ����E�� ����HCl����D��E�Ļ�ѧ����ʽ��
����HCl����D��E�Ļ�ѧ����ʽ��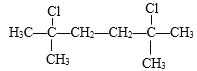 +
+![]()
![]()
 +2HCl��
+2HCl��
(4)E�� ��E��Ũ���ᡢŨ�����ϼ��ȷ���ȡ����Ӧ����F��
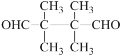
��E��Ũ���ᡢŨ�����ϼ��ȷ���ȡ����Ӧ����F�� �������Լ�a��Ũ���ᡢŨ���ᡣ
�������Լ�a��Ũ���ᡢŨ���ᡣ
(5)��������������֪G��H��������L�Ľṹ��ʽ��![]() ��
��
(6)B�� �������Ͷ���2��B��ͬ���칹������������������ܷ���������Ӧ��˵������ȩ�����ں˴Ź�������ֻ���������շ壬˵�������к���2�ֲ�ͬ��Hԭ�ӣ���ͬ���칹��߶ȶԳƣ����ϸ�������ͬ���칹��ṹ��ʽ�ǣ�
�������Ͷ���2��B��ͬ���칹������������������ܷ���������Ӧ��˵������ȩ�����ں˴Ź�������ֻ���������շ壬˵�������к���2�ֲ�ͬ��Hԭ�ӣ���ͬ���칹��߶ȶԳƣ����ϸ�������ͬ���칹��ṹ��ʽ�ǣ� ��
��
(7)D��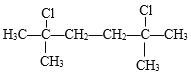 ��E��
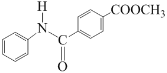
��E�� ��D��E�Ĺ����з���������H��ȡ����Ӧ��Hԭ��λ�ò�ͬ�����ﲻͬ������ж��ָ�����������ڸ߷��ӻ�����Ľṹ��ʽ��
��D��E�Ĺ����з���������H��ȡ����Ӧ��Hԭ��λ�ò�ͬ�����ﲻͬ������ж��ָ�����������ڸ߷��ӻ�����Ľṹ��ʽ�� ��
��
(8)�������Ʒ�����I�� ��H��
��H�� �����������ڷ�Ӧ������̼���ṹ���䣬�м�������л���2��AlCl3�����·�Ӧ����H����������Ϣ��֪Ӧ���DZ�����2����λHԭ�ӷ�����ȡ����Ӧ������H�����Ƶ�֪�м������
�����������ڷ�Ӧ������̼���ṹ���䣬�м�������л���2��AlCl3�����·�Ӧ����H����������Ϣ��֪Ӧ���DZ�����2����λHԭ�ӷ�����ȡ����Ӧ������H�����Ƶ�֪�м������ ���л���2��
�����2��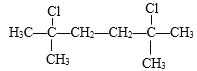 ������
������![]() ���л���1��DMAP�����·�Ӧ�����м����
���л���1��DMAP�����·�Ӧ�����м���� �����ݶ��߷��ӽṹ�IJ�ͬ�������֪����֪�л���1��
�����ݶ��߷��ӽṹ�IJ�ͬ�������֪����֪�л���1��![]() ��
��


 ȫ�ܲ����ĩС״Ԫϵ�д�
ȫ�ܲ����ĩС״Ԫϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ˮ��Һ�д��ڵ���ƽ�⡢ˮ��ƽ�⡢�ܽ�ƽ�⣬��ش��������⡣
��1����֪��������ĵ��볣�����±���
���� | CH3COOH | HCN | H2CO3 |
���볣��(25��) | Ka = 1.8��10��5 | Ka=4.3��l0��10 | Ka1=5.0��l0��7 Ka2=5.6��l0��11 |
�ٳ����£�pH��ͬ��������Һ��A��CH3COONa B��NaCN C��Na2CO3�������ʵ���Ũ���ɴ�С��˳����_______________(����)��
�ڽ�����CO2ͨ��NaCN��Һ����Ӧ�����ӷ���ʽ��____________________________��
�������£�����Ũ�ȵ�CH3COONa��ҺpH=9�������ӷ���ʽ��ʾ��Һ�ʼ��Ե�ԭ����__________________����Һ��c(CH3COO��)/c(CH3COOH) =___________
��2�������£���0.100 mol/L������Һ�ζ�20.00mL0.l00mol/L ��ij��ˮ��Һ���ζ�������ͼ��ʾ��������Ϊ������������

�� d����ʾ����Һ������Ũ���ɴ�С��˳������Ϊ__________________________________��
�� b����ʾ����Һ��c(NH3��H2O)��c(NH4+)=________(����Һ�е���������Ũ�ȱ�ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���Ҿ�����KMnO4�����Ũ���ᷴӦ�Ʊ���������ѧ����ʽ���£�2KMnO4 �� 16HCl��Ũ�� �� 2KCl �� 2MnCl 2�� 5Cl 2�� �� 8H2O��
��1���õ����ű������ת�Ƶķ������Ŀ:__________��
��2�����˷�Ӧ��дΪ���ӷ���ʽ��___________________��
��3����31.6g KMnO4�����Ũ�����ַ�Ӧ����������HCl�����ʵ���Ϊ_____���ڱ�״�������ɵ�Cl 2�����Ϊ____��
��4�������ɵ�����ͨ�������װ������֤������ijЩ���ʡ�
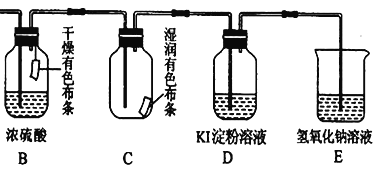
�����ӷ���ʽ����C����ɫ������ɫ��ԭ��______________����B��C��˳��ߵ����ɷ�ﵽԭ����ʵ��Ŀ�ģ�______����������������������������D�����������������ʵ�ʵ�飬�ɹ۲쵽��Һ����ɫ��Ϊ��ɫ��I2���������۱���ɫ������Ƚ�Cl2��I2 ��KMnO4 �������ԣ���ǿ����Ϊ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������϶�����Ŀǰһ��ʹ��������(M��ʾ����Ͻ�������ɲ��������ʱ����ش��ڳ��״̬)�������س�ŵ�ԭ����ʾ��ͼ���£�

���ܷ�ӦʽΪ![]() ������������Ϣ�жϣ�����˵���������
������������Ϣ�жϣ�����˵���������
A. ��϶����������»����ʱ���ҵ缫�ĵ缫��ӦʽΪ��NiOOH+H2O+e��==Ni(OH)2+OH��
B. ��϶����������»����ʱ�����Һ��OH����缫�ƶ�
C. ��϶����������»�ɲ��ʱ���缫��Χ��Һ��pH��С
D. ��϶����������»�ɲ��ʱ�������ķ���Ϊ���缫�����������ҵ缫
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��T��Q��Z ����Ԫ�أ�λ��Ԫ�����ڱ�ǰ�����ڣ�Ԫ�ص����ʻ�ṹ��Ϣ�����
Ԫ�� | ���ʻ�ṹ��Ϣ |
X | ����Ϊ˫ԭ�ӷ��ӣ������к���3�Թ��õ��Ӷԣ������µ������������ȶ�������ԭ�ӽϻ��� |
Y | ��̬ԭ�ӵ�3p�������4������ |
T | ԭ�Ӻ���s���������������p������������������ں�������Ԫ�أ����䵥���dz�������ȼ�� |
Q | ������������Ԫ����ԭ�Ӱ뾶��С |
Z | ��̬ԭ�ӵ�2��������M����ȫ���������� |
�����������Ϣ�ش��������⣺
��1��д��X3����һ�ֵȵ�����Ļ�ѧʽ___��
��2��д��TԪ�ػ�̬ԭ�ӵĺ�������Ų�ͼ___��
��3��Ԫ��X��T�ĵ縺����ȣ�___��С����Ԫ�����ƣ���Ԫ��X�ĵ�һ��������T��Ƚϣ�T��___�����С������
��4����ZԪ�������ڱ���λ��__����Z���ʾ�����Zԭ������ά�ռ���Ķѻ���ʽΪ___�ѻ���
��Z���Ȼ����백ˮ��Ӧ���γ������[Z��NH3��4��H2O��2]Cl2������������ʱ������ʧȥ�����е�������___��д��ѧʽ����
��5��Ԫ��X��Q���γɻ�����XQ3�����ݼ۲���ӶԻ��������ж�XQ3�Ŀռ乹��Ϊ___��������Xԭ�ӵ��ӻ���ʽΪ___�ӻ���
��6��Y��Z���γɻ����ᄃ��ľ�����ͼ��ʾ���û�����Ļ�ѧʽΪ___��
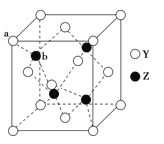
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴ӦaA (g) + bB (s) ![]() cC (g) + dD (g)�ڷ�Ӧ�����У������������䣬C�����ʵ���������T��P��ϵ��ͼ��ʾ��������������ȷ���ǣ� ��
cC (g) + dD (g)�ڷ�Ӧ�����У������������䣬C�����ʵ���������T��P��ϵ��ͼ��ʾ��������������ȷ���ǣ� ��
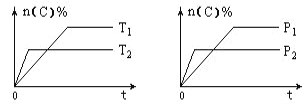
A. �¶Ƚ��ͣ���ѧƽ�����淴Ӧ�����ƶ�
B. ʹ�ô�����C�����ʵ�����������
C. ��ѧ����ʽϵ��a ��c��d
D. ������ͼ��ȷ���ı��¶Ⱥ�ѧƽ���ƶ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ���������ֵ������˵����ȷ���ǣ� ��
A.��⾫��ͭʱ���������õ�������Ϊ2NA������������������64 g
B.0.1 mol KI��0.1 mol FeCl3����Һ�з�Ӧת�Ƶĵ�����Ϊ0.1NA
C.1 L 0.5 mol��L-1��������Һ����������������Ŀ����NA
D.0.1 mol��������(![]() )�к��й��ۼ�������ԼΪ0.3��6.02��1023
)�к��й��ۼ�������ԼΪ0.3��6.02��1023
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NiԪ�������������������Ź㷺��Ӧ�á��ش���������:
(1)��̬Niԭ�Ӽ۲���ӵ��Ų�ʽΪ_______��
(2)��ѧ�����о�������������ֵĹ����У�������Cu-Ni-Fe�ȶ��ֽ��������ȷ��ij�ֽ����������Ǿ��廹�ǷǾ�����ɿ��Ŀ�ѧ�����ǶԹ������______��
(3)Ni������±��(SCN)2��Ӧ����Ni(SCN)2��Ni(SCN)2�У���һ����������Ԫ����____��(SCN)2�����У���ԭ�ӵ��ӻ���ʽ��___��������������Ŀ֮��Ϊ_____��
(4)[Ni(NH3)6](NO3)2�У������ڵĻ�ѧ��Ϊ_____(����)��
a�����Ӽ� b�������� c����λ�� d�����
(5)����CO��N2���۷е�ߵ�ԭ��___��
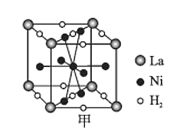
(6)���Ͻ�����о���ȡ�úܴ��չ��
��ͼ����һ�������Ͻ����ľ����ṹʾ��ͼ���úϽ����1 mol La�ĺϽ������H2����ĿΪ___��
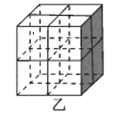
��Mg2NiH4��һ������Ľ����⻯���Mg2NiH4�����У�Niԭ��ռ����ͼ�ҵĶ�������ģ�Mg2+������ͼ�˸�С����������ġ�Mg2+λ��Niԭ���γɵ�___�������������϶�������������϶��������������ܶ�Ϊd g/cm3��Mg2NiH4��Ħ������ΪM g/mol����Mg2+��Niԭ�ӵ���̾���Ϊ___nm(�ú�d��M��NA�Ĵ���ʽ��ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ӵ������������Ҫ���Ƚϸߵ������̣�Ŀǰ��ҵ������������(�ơ�þ������)�����ߣ�������ͼ���̿���ȡ���Ƚϸߵ���������Һ��

��Ӧ��ʹ�������ɷ�����ij������Է�Ӧ��ǰ������ʺ��������(��350g/LMnSO4��)���£�
���� | ����ǰ/g | ������/g | ȥ����/% |
Fe2+��Fe3+ | 0.001275 | 0.001275 | �� |
Ca2+ | 0.490000 | 0.021510 | 95.61 |
Mg2+ | 0.252000 | 0.025100 | 90.04 |
(1)����x��������_____��
(2)�Է�����þȥ�������ͬ��ԭ��_____��
(3)����Һ�м���KMnO4���Խ�Fe2+����ΪFe3+��ͬʱ����Mn2+���÷�Ӧ�����ӷ���ʽΪ_____��
(4)��֪�������������������pH
Fe(OH)2 | Fe(OH)3 | Mn(OH)2 | |
��ʼ����ʱ | 6.3 | 1.5 | 8.3 |
��ȫ����ʱ | 8.3 | 2.8 | 9.8 |
ע���������ӵ���ʼŨ��Ϊ0.1mol/L
���ݱ������ݽ��������Тڵ�Ŀ�ģ�_____��
(5)��һ���о������������Ӧ�ٺ���ֱ�Ӽ���KMnO4��ͬʱ���Ƽ����������Ӧ�����pH��Ȼ���ٹ��ˣ����Խ�һ����߸�þ��ȥ���ʣ���þȥ������ߵ�ԭ�������¼��裺
����I��Fe2+��������Fe3+��Fe3+ˮ�����ɵ�Fe(OH)3�����˳����
����II��Mn2+�뷴Ӧ���ɵĻ���MnO2�����˳����
ѡ���ʵ������Լ������ʵ����֤�����Ƿ����____________________��
(6)����ӵ�س�ŵ�����У����������������֮�������ƶ�������һ��ҡ�Σ�����ҡ��ʽ����������͵�����ӵ�ع���ԭ����ͼ��ʾ��

�ٷŵ�ʱLi+���ƶ������__________������_____(����a������b��)��
����֪�缫�ܷ�Ӧ��LiCoO2+C![]() Li1��xCoO2+CLix��д���ŵ�ʱ�����ĵ缫��Ӧʽ__��
Li1��xCoO2+CLix��д���ŵ�ʱ�����ĵ缫��Ӧʽ__��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com