
【题目】(1)粗制CuSO4·5H2O晶体中常含有杂质Fe2+。
①在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质最好选用的是________。
A.KMnO4 B.H2O2 C.氯水 D.HNO3
②然后再加入适当物质调整溶液至pH=4,使Fe3+转化为Fe(OH)3,调整溶液pH可选用下列中的_______。
A.NaOH B.NH3·H2O C.CuO D.Cu(OH)2
(2)在25 ℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式),生成该沉淀的离子方程式为________。已知25 ℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。
(3)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,![]() =____。已知Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10。
=____。已知Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10。
【答案】B CD Cu(OH)2 Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+ 2.7×10-3
【解析】
(1)加入合适氧化剂,使Fe2+氧化为Fe3+,不能引入新的杂质;调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,则加含铜元素的物质与氢离子反应促进铁离子水解转化为沉淀;
(2)由Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20可知,氢氧化铜更难溶,先生成;
(3)当两种沉淀共存时,溶液是AgCl和AgBr的饱和溶液,溶液中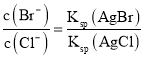 ,以此来解答。
,以此来解答。
(1)①加入合适氧化剂,使Fe2+氧化为Fe3+,不能引入新的杂质,A、C、D中会引入杂质,只有过氧化氢的还原产物为水,不引入杂质,故合理选项是B;
②调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,则加含铜元素的物质与氢离子反应促进铁离子水解转化为沉淀,则C、D均可以,A、B将Cu2+转化为Cu(OH)2沉淀,不符合题意,故合理选项是CD;
(2)难溶电解质的溶度积越小,加入氨水时越易生成沉淀,则生成的沉淀为Cu(OH)2,反应的离子方程式为Cu2++2NH3H2O= Cu(OH)2↓+2NH4+;
(3)当两种沉淀共存时,溶液是AgCl和AgBr的饱和溶液,溶液中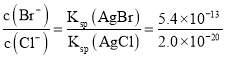 ==2.7×10-3。
==2.7×10-3。


科目:高中化学 来源: 题型:
【题目】已知2SO2(g)+O2(g)2SO3(g) △H=-198kJmol-1,当有V2O5存在时,该反应机理为:V2O5+SO2→2VO2+SO3(快);4VO2+O2→2V2O5 (慢),下列说法正确的是( )
A.由反应机理可知VO2和V2O5都是该反应的催化剂
B.该反应在高温下易自发进行
C.该反应的逆反应的活化能大于198kJmol-1
D.当V2O5存在时,加快化学反应速率,△H会减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各离子①H+ ②Cl- ③Al3+ ④K+ ⑤S2- ⑥OH- ⑦NO3- ⑧NH4+中,不影响水的电离平衡的是( )
A.①③⑤⑦⑧B.②④⑦C.①⑥D.②④⑥⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验、类比、推理是化学学习的重要方法.对下列过程的类比正确的是![]()
实验 | 类比实验 | |
A |
| 则 |
B | 将Fe投入至冷的浓硫酸中不发生明显变化 | 则Cu投入至冷的浓硫酸也不会反应 |
C |
|
|
D | 乙醛可以使得 | 乙醛也可使得溴水褪色 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活污水中的氮和磷主要以铵盐和磷酸盐形式存在,可用电解法从溶液中去除。电解装置如图:

以铁作阴极、石墨作阳极,可进行除氮;翻转电源正负极,以铁作阳极、石墨作阴极,可进行除磷。
I.电解除氮
(1)在碱性溶液中,NH3能直接在电极放电,转化为N2,相应的电极反应式为:_______。
(2)有Cl-存在时,除氮原理如图所示

主要依靠有效氯(HClO、ClO-)将NH4+ 或NH3氧化为N2。在不同pH条件下进行电解时,氮的去除率和水中有效氯浓度如图:

①当pH<8时,主要发生HClO氧化NH4+ 的反应,其离子方程式为:____________。
②结合平衡移动原理解释,当pH<8时,氮的去除率随pH的降低而下降的原因是:_____。
II.电解除磷
(3)除磷的原理是利用Fe2+ 将PO43- 转化为Fe3(PO4)2沉淀。
如图为某含Cl- 污水在氮磷联合脱除过程中溶液pH的变化。推测在20-40 min时脱除的元素是________。

(4)测定污水磷含量的方法如下:取100mL污水,调节至合适pH后用AgNO3溶液使磷全部转化为Ag3PO4沉淀。将沉淀过滤并洗涤后,用硝酸溶解,再使用NH4SCN溶液滴定产生的Ag+,发生反应Ag++SCN-=AgSCN↓,共消耗c mol/LNH4SCN溶液V mL。则此污水中磷的含量为_________mg/L(以磷元素计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯苯是染料、医药、有机合成的中间体,是重要的有机化工产品。实验室制取氯苯的装置如图所示(加热和固定仪器的装置已略去)。
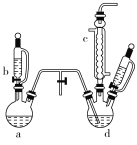
回答下列问题:
(1)如果用a和b仪器组合成制取氯气的装置,反应无需加热,则a仪器中的固体反应物可以是________(填序号)。
A.MnO2 B.KMnO4 C.K2Cr2O7
(2)仪器c的名称是________。
(3)制取氯苯的化学方程式为________________。
(4)仪器d中的反应完成后,工业上要进行水洗、碱洗及食盐干燥,才能蒸馏。碱洗之前要进行水洗,其目的是______________________。
(5)生成的氯气中存在HCl、H2O等杂质气体,若需要增加一个装置除去水蒸气,请在下框中画出,并标明所用试剂。
__________
(6)工业生产中苯的流失情况如表所示:
项目 | 二氯苯 | 氯化尾气 | 蒸气 | 成品 | 不确定苯耗 | 合计 |
苯流失量/(kg·t-1) | 11.7 | 5.4 | 20.8 | 2.0 | 49.3 | 89.2 |
则10 t苯可制得成品氯苯________t。(列出计算式即可。氯苯和苯的相对分子质量分别是112.5和78)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外小组用右图装置制取溴苯并探究该反应的类型。先向分液漏斗中加入苯和液溴,再将混合液滴入反应器A(A下端活塞关闭)中。
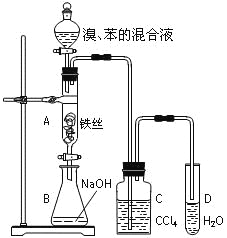
(1)写出A中反应的化学方程式:________________________________________。
(2)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是_________________________。
(3)C中盛放CCl4的作用是_____________________________。
(4)若要证明苯和液溴发生的是取代反应,而不是加成反应,通常有两种方法,请按要求填写下表。
向试管D中加入的试剂 | 能证明苯与液溴发生取代反应的现象 | |
方法一 | _____________ | _________________ |
方法二 | _____________ | _________________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如图所示实验,探究反应中的能量变化。
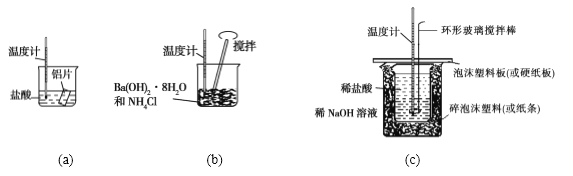
下列判断正确的是
A. 由实验可知,(a)、(b)、(c)所涉及的反应都是放热反应
B. 将实验(a) 中的等质量的铝片换成铝粉后,释放出的热量有所增加
C. 实验(c)中将环形玻璃搅拌棒改为铁质搅拌棒对实验结果没有影响
D. 若用NaOH固体测定中和热,则测定结果偏高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化氮(NCl3)是一种淡黄色的油状液体,下面对于NCl3的描述不正确的是( )
A.NCl3为三角锥形B.NCl3是一种极性分子
C.它还能再以配位键与Cl-结合D.NCl3的挥发性比PBr3要大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com