
| A. | 65:(A-65) | B. | 64:(A-65) | C. | 65:(A-64) | D. | 64:(A-64) |
分析 发生反应为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O、Zn+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ZnSO4+SO2↑+2H2O,设出合金中铜和锌的质量,然后利用差量法列式计算.
解答 解:设合金中含有Cu、Zn的物质的量为x、y,
则:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O 溶液增加质量
64 64 0
Zn+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ZnSO4+SO2↑+2H2O 溶液增加质量
65 64 1
y $\frac{y}{65}$,
则溶液所增加的质量为$\frac{y}{65}$,增加质量与原合金质量之比=$\frac{\frac{y}{65}}{x+y}$=1:A,解得:y:x=65:(A-65),
即:原合金中Zn、Cu的质量之比为65:(A-65),
故选A.
点评 本题考查了化学方程式的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握差量法在化学计算中的应用方法,试题培养了学生的化学计算能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 L 3mol•L-1的NH4NO3溶液中含有的NH4+数目为0.3NA | |
| B. | 1mol金刚石中含有的共价键数目为4NA | |
| C. | 1molNa2O2与足量的水反应,转移的电子数为2NA | |
| D. | 分子数为NA的CO、N2的混合气体在标准状况时体积约为22.4L,质量为28g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
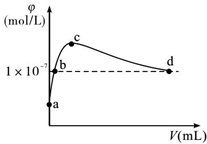 常温下,将CO2通入2LpH=12的KOH溶液中.溶液中水电离出的OH-离子浓度(φ)与通入的CO2的体积(V)的关系如图所示.下列叙述不正确的是( )
常温下,将CO2通入2LpH=12的KOH溶液中.溶液中水电离出的OH-离子浓度(φ)与通入的CO2的体积(V)的关系如图所示.下列叙述不正确的是( )| A. | a点溶液中:水电离出的c(H+)=1×10-12mol/L | |
| B. | b点溶液中:c(H+)=1×10-7mol/L | |
| C. | c点溶液中:c(K+)=2[c(CO${\;}_{3}^{2-}$)+c(HCO3-)+c(H2CO3)] | |
| D. | d点溶液中:c(K+)=2c(CO${\;}_{3}^{2-}$)+c(HCO${\;}_{3}^{-}$) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | HCl | B. | Na2CO3 | C. | NaCl | D. | KOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向1mol的碳酸钾固体中缓缓滴加含1 mol溶质的稀盐酸会产生1mol的CO2气体 | |
| B. | 标准状况下,将64g 铜片投入到含 2 molH2SO4的浓硫酸中加热会产生22.4 L的SO2气体 | |
| C. | 标准状况下,用一充满氨气的干燥烧瓶做喷泉实验,当水充满整个烧瓶后(假设溶液不外溢),烧瓶内氨水的物质的量浓度为($\frac{1}{22.4}$)mol/L | |
| D. | 向含有1mol Ba(OH)2溶液中通入足量CO2气体产生1mol BaCO3白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸与石灰石反应CO32-+H+═CO2↑+H2O | |
| B. | 硫酸铜溶液中滴加氢氧化钡溶液Ba2++S042-═Ba+S04↓ | |
| C. | 氢氧化镁和盐酸反应:H++OH-═H2O | |
| D. | 氯化铝溶液中加人过量氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com