
【题目】下列事实不能用勒夏特列原理来解释的是
A. 用排饱和食盐水的方法收集氯气
B. 加入催化剂使N2和H2在一定条件下生成氨气
C. 增大压强,有利于SO2和O2反应生成SO3
D. 在Fe3+ + 3SCN- ![]() Fe(SCN)3反应达平衡时,增加KSCN的浓度,体系颜色变深
Fe(SCN)3反应达平衡时,增加KSCN的浓度,体系颜色变深
 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:
【题目】锌是一种常用金属,冶炼方法有火法和湿法。回答下列问题:
I. 镓(Ga)是火法冶炼锌过程中的副产品,镓与铝同主族且相邻,化学性质与铝相似。
(1)Ga在元素周期表中的位置为_______________。
(2)GaN可由Ga和NH3在高温条件下合成,该反应的化学方程式为_______________。
(3)下列有关镓和镓的化合物的说法正确的是_____________(填字母)。
A. 一定条件下,Ga可溶于盐酸和氢氧化钠溶液
B. 常温下,Ga可与水剧烈反应放出氢气
C. Ga2O3可由Ga(OH)3受热分解得到
D. 一定条件下,Ga2O3可与NaOH反应生成盐
II. 工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量CaO、FeO、CuO、NiO等氧化物)湿法制取金属锌的流程如图所示。
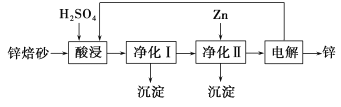
已知:Fe的活泼性强于Ni。
(4)ZnFe2O4可以写成ZnO·Fe2O3,写出ZnFe2O4与H2SO4反应的化学方程式___________________。
(5)净化I操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,仅使Fe3+转化为Fe(OH)3沉淀。净化I生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是____________________________________。
(6)净化II中加入Zn的目的是_______________________________________。
III. (7)某化学课外小组拟用废旧电池锌皮(含杂质铁),结合如图所示信息,从提供的试剂中选取适当试剂,制取纯净的ZnSO4·7H2O。

实验步骤如下:
①将锌片完全溶于稍过量的3mol·L-1的稀硫酸,加入_______(选填字母,下同);
A. 30%H2O2 B. 新制氯水
C. FeCl3溶液 D. KSCN溶液
②加入__________;
A. 纯锌粉 B. 纯碳酸钙粉末
C. 纯ZnO粉末 D. 3mol·L-1的稀硫酸
③加热到60℃左右并不断搅拌;
④趁热过滤得ZnSO4溶液,再蒸发浓缩、冷却结晶,过滤、洗涤、干燥。
其中步骤③加热的主要目的是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3是重要的化工原料,无水氯化铁在300℃以上升华,遇潮湿空气极易潮解
(1)制备无水氯化铁

①仪器X的名称为____。
②装置的连接顺序为a→____→i,k→____(按气流方向,用小写字母表示)。
③实验结束后,取少量F中的固体加水溶解,经检测发现溶液中含有Fe2+,其原因为____。
(2)探究FeCl3与SO2的反应
已知反应体系中存在下列两种化学变化:
(i) Fe3+与SO2发生络合反应生成Fe(SO2)62+(红棕色);
(ii) Fe3+与SO2发生氧化还原反应,其离子方程式为①____

②_________
③_________
④实验结论:反应(i)、(ii)的活化能大小关系是:E(i)____E(ii)(填“>”、 “<”或“=”,下同),平衡常数大小关系是:K(i)__________K(ii)。
⑤另取5 mL l mol![]() L-l FeC13溶液,先滴加2滴浓盐酸,再通入SO2至饱和。几分钟后,溶液由黄色变为浅绿色,由此可知:促使氧化还原反应(ii)快速发生可采取的措施是____。
L-l FeC13溶液,先滴加2滴浓盐酸,再通入SO2至饱和。几分钟后,溶液由黄色变为浅绿色,由此可知:促使氧化还原反应(ii)快速发生可采取的措施是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向盛有Cl2的三个集气瓶甲、乙、丙中各注入下列液体中的一种,经过振荡,现象如下图所示,则甲、乙、丙中注入的液体分别是( )

A. ①②③ B. ③②① C. ②①③ D. ①③②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,反应aA(g)![]() bB(g) 达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则错误的是( )
bB(g) 达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则错误的是( )
A. 平衡向正反应方向移动了 B. 物质A的转化率增大了
C. 物质B的质量分数增加了 D. a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数的值为NA,下列说法正确的是
A. 1 L 1 mol/L葡萄糖溶液含有氧原子数为6NA
B. 氯气通入到含有1mol的FeBr2溶液中,当有NA个Br-被氧化时,共消耗标准状况下氯气22.4L
C. 标准状况下,2.24 L HF中所含质子数目为NA
D. 4.4 g由14CO2与14N2O组成的混合物中所含中子数为2.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ⅥA族元素形成的化合物在实验室和工业生产上有着广泛的应用。回答下列问题:
(1)SCN-与Fe3+可形成多种配离子,其中一种为[Fe(SCN)6]3-,该配离子中的SCN-会使Fe3+的剩余价电子压缩配对,则每个配离子中Fe3+的单电子个数为_________个。
(2)Se与S是同族元素,请写出基态Se原子电子排布式_____________。H2Se的酸性比H2S________(填“强”或“弱”)。H2O、H2S、H2Se沸点由高到低的顺序为__________________,原因是:___________。
(3)有一种由1~9号元素中的部分元素组成,且与SCl2互为等电子体的共价化合物,它的分子式为_______,其VSEPR构型为_____________。
(4)已知S4O62-的结构为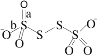 ,其中S原子的杂化方式是_______________。键长a______b(填“>”、“<”或“=”)。
,其中S原子的杂化方式是_______________。键长a______b(填“>”、“<”或“=”)。
(5)离子晶体中阳离子和阴离子的半径比不同可形成不同的晶胞结构,见下表:
半径比 | 0.225~0.414 | 0.414~0.732 | 0.732~1 |
典型化学式 | 立方ZnS | NaCl | CsCl |
晶胞 |
|
|
|
已知某离子晶体RA,其阴阳离子半径分别为184pm和74pm,摩尔质量为M g/mol,则阳离子配位数为___________,晶体的密度为_________g/cm3(列出计算式,无需化简,设NA为阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )

A.图甲表示某可逆反应物质的浓度随时间的变化,且在t时刻达到平衡状态
B.图乙表示向0.1 mol·L–1的氨水溶液中逐渐加水时溶液的导电性变化
C.图丙表示某放热反应分别在有、无催化剂的情况下,反应过程中的能量变化
D.图丁表示向CH3COOH溶液中逐渐加入CH3COONa固体后,溶液pH的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:

已知:气体分压(P分)=气体总压(P总)×体积分数。下列说法正确的是
A. 550℃时,若充入惰性气体,正,逆 均减小,平衡不移动
B. 650℃时,反应达平衡后CO2的转化率为25.0%
C. T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D. 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=24.0P总
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com