
 A、B、C、D、E五种短周期元素,原子序数E>D>A>B>C,且A、B、D、E同周期,A、C同主族,A的原子结构示意图如图,B的最外层电子数比K层电子多1,D元素的主族序数是周期序数的2倍,E的单质是黄绿色气体;据此填空:
A、B、C、D、E五种短周期元素,原子序数E>D>A>B>C,且A、B、D、E同周期,A、C同主族,A的原子结构示意图如图,B的最外层电子数比K层电子多1,D元素的主族序数是周期序数的2倍,E的单质是黄绿色气体;据此填空:分析 A、B、C、D、E五种短周期元素,原子序数E>D>A>B>C,根据A的原子结构示意图可知,x=2,故A的质子数为14,则A为Si元素;A、B、D、E同周期,则均为第三周期元素,B的最外层电子数比K层电子多1,最外层电子数为3,则B为Al,D元素的主族序数是周期序数的2倍,则D为S元素,E的单质是黄绿色气体,则E为Cl,A、C同主族,则C为碳元素.
解答 解:A、B、C、D、E五种短周期元素,原子序数E>D>A>B>C,根据A的原子结构示意图可知,x=2,故A的质子数为14,则A为Si元素;A、B、D、E同周期,则均为第三周期元素,B的最外层电子数比K层电子多1,最外层电子数为3,则B为Al,D元素的主族序数是周期序数的2倍,则D为S元素,E的单质是黄绿色气体,则E为Cl,A、C同主族,则C为碳元素.
(1)元素A为Si元素,在周期表中的位置:第三周期ⅣA族,故答案为:第三周期ⅣA族;
(2)同周期随原子序数增大元素非金属性增强,故非金属性S<Cl,
A.单质的熔沸点属于物理性质,不能比较非金属性强弱,故A错误;
B.气态氢化物的熔沸点也属于物理性质,不能比较非金属性强弱,故B错误;
C.非金属性越强,对应氢化物越稳定,故C正确;
D.两种元素中置换能力越强,说明单质的氧化性越强,对应元素非金属性越强,故D正确,
故答案为:Cl;CD;
(3)非金属性Cl>S>C,故最高价氧化物的水化物的酸性:HClO4>H2SO4>H2CO3,
故答案为:HClO4>H2SO4>H2CO3.
点评 本题考查结构性质位置关系应用,侧重的对元素周期律的考查,注意掌握金属性、非金属性强弱比较实验事实.


科目:高中化学 来源: 题型:选择题
| A. | 原子半径:rW>rZ>rY | |
| B. | 化合物X2Y、ZY、ZX2中化学键的类型相同 | |
| C. | 由X、Y、Z、W组成的化合物的水溶液可能显酸性 | |
| D. | 由Y元素形成的离子与W元素形成的离子的电子数不可能相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在元素周期表中所示氮元素如图.化学家在研究人工固氮的过程中使用了N3-,下列对于N3-的说法中不正确的是( )
在元素周期表中所示氮元素如图.化学家在研究人工固氮的过程中使用了N3-,下列对于N3-的说法中不正确的是( )| A. | N3-是氮元素的一种新单质 | B. | N3-是带1个单位负电荷的阴离子 | ||
| C. | N3-的相对质量约为42 | D. | 1个N3-中有21个质子和22个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
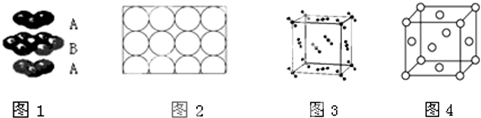
| A. | 钛和钾都采取图1的堆积方式 | |
| B. | 图2为金属原子在二维空间里的非密置层放置,此方式在三维空间里堆积,仅得简单立方堆积 | |
| C. | 图3是干冰晶体的晶胞,晶胞棱长为a cm,则在每个CO2周围最近且等距离的CO2有8个 | |
| D. | 图4是一种金属晶体的晶胞,它是金属原子在三维空间以密置层采取ABCABC…堆积的结果 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳在氧气中的燃烧 | B. | 葡萄糖在人体内氧化分解 | ||
| C. | Ba(OH)2•8H2O与NH4Cl反应 | D. | 锌粒与稀H2SO4反应制取H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 实验现象 | 实验结论 |
| A | 取少量食盐溶于水,加稀硫酸酸化再滴入淀粉溶液 | 溶液呈蓝色 | 食盐为加碘食盐 |
| B | 取两支试管,都加入2mL0.01mol/L的酸性KMnO4溶液,向其中一支试管加入2mL蒸馏水后,再同时向两支试管各加入2mL0.1mol/L的H2C2O4溶液 | 两试管中溶液紫色均褪去,且后者所用时间更短 | 酸性KMnO4溶液浓度越大,化学反应速率越快 |
| C | 向蛋白质溶液中加入CuCl2或 (NH4)2SO4饱和溶液 | 均有沉淀 | 蛋白质均发生了变性 |
| D | 将0.1mol/L MgSO4溶液滴入NaOH稀溶液至不再有沉淀产生,再滴加0.1mol/L CuSO4溶液 | 白色沉淀逐渐变为蓝色沉淀 | Ksp[Cu(OH)2]<Ksp[Mg(OH)2] |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com