
| A. | 钙离子的结构示意图: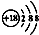 | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | CH4分子的球棍模型: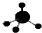 | D. | -CH3(甲基)的电子式为: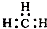 |
分析 A.钙离子核电荷数为20,不是18;
B.乙烯的结构简式中必须写出其官能团碳碳双键;
C.甲烷为正四面体结构,碳原子的原子半径大于氢原子;
D.甲基的C原子最外层为7个电子.
解答 解:A.钙离子核电荷数为20,核外电子数为18,所以钙离子的结构示意图为: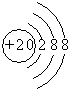 ,故A错误;
,故A错误;
B.结构简式中必须标出官能团,乙烯的结构简式为:CH2=CH2,故B错误;
C.甲烷为正四面体结构,甲烷的球棍模型为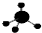 ,故C正确;
,故C正确;
D.甲基为中性原子团,其碳原子最外层为7个电子,甲基正确的电子式为: ,故D错误;
,故D错误;
故选C.
点评 本题考查了电子式、离子结构示意图、球棍模型等知识,题目难度中等,注意掌握电子式、分子式、结构简式、结构式的概念及区别,明确球棍模型与比例模型的表示方法.


科目:高中化学 来源: 题型:解答题
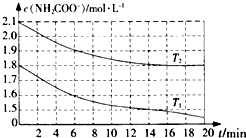 科学研究小组对氨基甲酸铵(NH2COONH4)的分解和水解反应进行探究.
科学研究小组对氨基甲酸铵(NH2COONH4)的分解和水解反应进行探究.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 化学式 | 颜色 | Ksp |
| AgCl | 白色 | 2.0×10-10 |
| AgBr | 浅黄色 | 5.4×10-13 |
| AgI | 黄色 | 8.3×10-17 |
| Ag2S | 黑色 | 2.0×10-48 |
| Ag2CrO4 | 红色 | 2.0×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
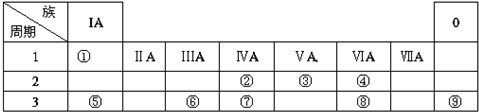
| 族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | ④ | ||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 乙烯和苯都能使溴水褪色,褪色的原因不相同 | |
| B. | 天然氨基酸能与强酸或强碱溶液反应 | |
| C. | 豆油、甘油、汽油都属于酯类 | |
| D. | 乙烯、苯、纤维素均属于烃类化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
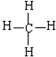 .
. ,形成的晶体是离子晶体.
,形成的晶体是离子晶体.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com