
【题目】用CaSO4代替O2与燃料反应是一种高效、清洁、经济的新型燃烧技术,如图1所示。
燃烧器中反应① 1/4CaSO4(s) + H2(g) = 1/4CaS(s) + H2O(g) △H1 (主反应)
反应② CaSO4(s) + H2(g) = CaO(s) + SO2(g)+ H2O(g) △H2 (副反应)
再生器中反应:1/2 CaS(s) + O2(g) = 1/2CaSO4(s) △H3
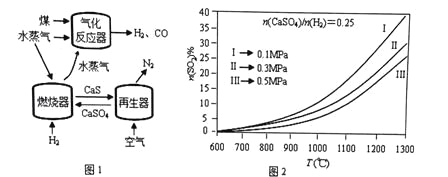
(1)气化反应器中发生反应的化学方程式是_____________________。
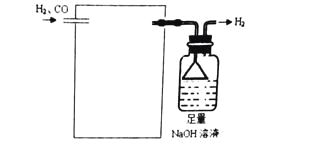
(2)燃烧器中SO2物质的量分数随温度T、压强p (MPa)的变化曲线见图2,从图2中可以得出三条主要规律:
①其他条件不变,温度越高,SO2含量越高;
②________________________________________________________;
③_________________________________________________________;
由图2,为减少SO2的排放量,可采取的措施是______________________。
(3)该燃烧技术中可循环的物质除CaSO4、CaS外,还有_________(写名称)。
(4)在一定条件下,CO可与甲苯反应,在其苯环对位上引入一个醛基,产物的结构简式为___________。
(5)欲采用氯化钯(PdCl2)溶液除去H2中的CO,完成以下实验装置图:
(注:CO + PdCl2 + H2O = CO2+ Pd + 2HCl)______________________
【答案】H2O(g) +C(s)![]() H2(g) +CO(g) 其它条件不变,压强越高,SO2含量越低 其它条件不变时,压强越小,温度对产物中SO2的含量影响更明显 降低温度,增大压强 水蒸气
H2(g) +CO(g) 其它条件不变,压强越高,SO2含量越低 其它条件不变时,压强越小,温度对产物中SO2的含量影响更明显 降低温度,增大压强 水蒸气 ![]()

【解析】
⑴根据图1知道气化反应器中的是C与水蒸气反应生成CO、H2,化学方程式为是H2O(g)+C(s)![]() H2(g)+CO(g)。
H2(g)+CO(g)。
(2)从图2中还可以看出压强也与SO2含量有关系,压强越大,SO2含量降低,所以为:②其他条件不变,压强越大,SO2含量越低;在三条曲线中Ⅰ曲线的变化最大,故③其他条件不变,压强越小,温度对产物中SO2的含量影响更明显;根据温度和压强对SO2质量分数的影响,要减少SO2的排放量,可采取的措施是加压、降温。
(3)从流程图中看出水可以循环使用。
(4)根据题目信息:在其苯环对位上引入一个醛基,则产物为:![]()
(5)混合进行洗气除杂时,气体要 “长进短出”,故装置是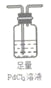 。
。


科目:高中化学 来源: 题型:
【题目】下列各反应的化学方程式中,属于水解反应的是( )
A.H2O+ H2O![]() H3O++OH-
H3O++OH-
B.CO2+H2O![]() H2CO3
H2CO3
C.HCO3-+OH-![]() H2O+CO32-
H2O+CO32-
D.CO32-+ H2O![]() HCO3- +OH-
HCO3- +OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g) ![]() CH3OH(g) ΔH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是
CH3OH(g) ΔH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是
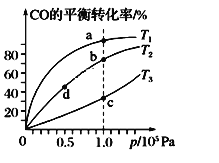
A.温度:T1>T2>T3
B.正反应速率:v(a)>v(c)、v(b)>v(d)
C.平衡常数:K(a)>K(c)、K(b)>K(d)
D.平均摩尔质量:M(a)>M(c)、M(b)>M(d)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化中,属于吸热反应的是( )
①液态水汽化②将胆矾加热变为白色粉末③浓H2SO4稀释 ④KClO3分解制O2⑤生石灰跟水反应生成熟石灰⑥石灰石高温分解⑦铝热反应⑧Ba(OH)2·8H2O与固体NH4Cl混合⑨C+H2O=CO+H2 ⑩Al与盐酸反应
A. ②③④⑥⑦⑧⑨ B. ②④⑥⑧⑨ C. ①②④⑥⑧ D. ②③④⑧⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在密闭容器内进行着某一反应,X气体![]() 、Y气体
、Y气体![]() 的物质的量随反应时间变化的曲线如图.下列叙述中正确的是
的物质的量随反应时间变化的曲线如图.下列叙述中正确的是![]()
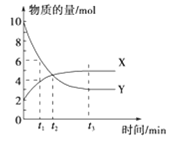
A.反应的化学方程式为![]()
B.![]() 时,Y的浓度是X浓度的
时,Y的浓度是X浓度的![]() 倍
倍
C.![]() 时,正、逆反应速率相等
时,正、逆反应速率相等
D.![]() 时,逆反应速率大于正反应速率
时,逆反应速率大于正反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由碳酸锰矿(主要成分MnCO3,还含有FeCO3、MnO2、Al2O3、SiO2等)中提取金属锰的一种流程如下:
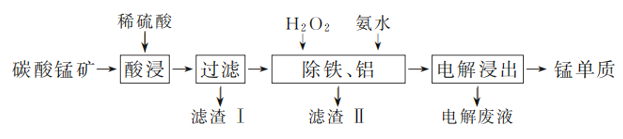
(1) “酸浸”过程中,提高锰元素浸出率的措施有:适当提高酸的浓度、________________(填一种)。
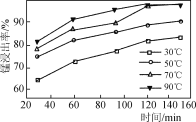
(2) 保持其他条件不变,在不同温度下对碳酸锰矿进行酸浸,锰元素的浸出率随时间变化如下图所示,则酸浸的最佳温度和时间分别是________。
提取过程中相关金属离子生成氢氧化物沉淀的pH
金属离子 | Fe3+ | Fe2+ | Al3+ | Mn2+ |
开始沉淀的pH | 1.8 | 5.8 | 3.0 | 7.8 |
完全沉淀的pH | 3.2 | 8.8 | 5.0 | 9.8 |
(3) 已知“酸浸”后溶液中锰元素只以Mn2+形式存在,则“酸浸”中发生氧化还原反应的离子方程式为________________________________________。
(4) 结合上表,“除铁、铝”时加入氨水控制反应液pH的范围为________。
(5) 若上述流程中加入的H2O2不足量,则待电解溶液中会有铁元素残余,进而会影响最终锰的纯度。请设计简要实验方案加以验证待电解溶液中是否含有铁元素: _________________。
(6) 以石墨为电极电解除铁、铝后的溶液获得单质锰。电解废液中可循环利用的溶质是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100℃时,在1 L恒温恒容的密闭容器中,通入0.1molN2O4,发生反应:N2O4(g)![]() 2NO2(g)ΔH=+57.0kJ·mol-1,NO2和N2O4的浓度随时间变化情况如图所示。
2NO2(g)ΔH=+57.0kJ·mol-1,NO2和N2O4的浓度随时间变化情况如图所示。
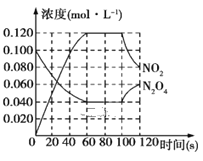
Ⅰ.(1)在0~60 s内,以N2O4表示的平均反应速率为____mol·L-1·s-1。
(2)反应进行到100s时,若只有一项条件发生变化,则变化的条件可能是____。
A.降低温度 B.通入氦气
C.又往容器中充入N2O4 D.增大容器容积
(3)已知: N2(g)+2O2(g)=2NO2(g) ΔH=+67.2kJ·mol-1,N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534.7kJ·mol-1,N2O4(g)=2NO2(g) ΔH=+57.0kJ·mol-1,则2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH=____kJ·mol-1。
Ⅱ.向容积为2 L的密闭容器中通入一定量的CO和H2O,发生反应:CO(g)+H2O(g)![]() H2(g)+CO2(g)。
H2(g)+CO2(g)。
(4)保持其他条件不变:
①若向平衡体系中再通入0.20molH2O(g),平衡将___(填“向右”、“向左”或“不”)移动,达到新的平衡状态后,H2O(g)的体积分数将____(“变大”、“变小”或“不变”);
②在VL密闭容器中通入10molCO和10molH2O(g)发生上述反应,在T℃达到平衡,然后急速除去水蒸气(除水蒸气时其他各成分的物质的量不变),将混合气体燃烧,测得放出的热量为2842kJ(已知CO的燃烧热为283kJ·mol-1,H2的燃烧热为286kJ·mol-1),则T℃平衡常数K=____。(精确到小数点后两位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】凯夫拉纤维是生产防弹衣的主要材料之一,其结构片段如下:

下列说法不正确的是( )
A. 凯夫拉纤维在发生水解反应的过程中,![]() 中的C—N键断裂
中的C—N键断裂
B. 凯夫拉纤维的结构简式为: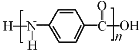
C. 完全水解产物的单个分子中,苯环上的氢原子具有相同的化学环境
D. 通过质谱法测定凯夫拉纤维的平均相对分子质量,可得其聚合度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳和氮的化合物在生产生活中广泛存在。回答下列问题:
(1)三氯化氮(NCl3)是一种黄色、油状、具有刺激性气味的挥发性有毒液体,各原子均满足8电子稳定结构。其电子式是__________________。氯碱工业生产时,由于食盐水中通常含有少量NH4Cl,而在阳极区与生成的氯气反应产生少量NCl3,该反应的化学方程式为_____________。
(2)一定条件下,不同物质的量的CO2与不同体积的1.0mol/LNaOH溶液充分反应放出的热量如下表所示:
反应序号 | n (CO2)/mol | V (NaOH) /L | 放出的热量/kJ |
1 | 0.5 | 0.75 | a |
2 | 1.0 | 2.00 | b |
该条件CO2与NaOH 溶液反应生成NaHCO3的热化学反应方程式为______________________。
(3)利用CO可以将NO转化为无害的N2,其反应为: 2NO(g) +2CO(g) ![]() N2(g) +2CO2(g),向容积均为1L的甲、乙两个恒温(温度分别为300℃、T℃)容器中分别加入2.00molNO和2.00molCO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
N2(g) +2CO2(g),向容积均为1L的甲、乙两个恒温(温度分别为300℃、T℃)容器中分别加入2.00molNO和2.00molCO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
N甲(CO)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
N乙(CO)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
/p>
①甲容器中,0~40min 内用NO的浓度变化表示的反应速率v(NO)=_____________。
②该反应的△H____0(填“>”或“<”)。
③甲容器反应达到平衡后,若容器内各物质的量均增加1倍,则平衡______(填“正向”、“逆向”或“不”)移动。
(4)常温下, 在(NH4)2C2O4溶液中,反应NH4++C2O42-+H2O![]() NH3·H2O+HC2O4-的平衡常数K=________________________。(已知常温下,NH3·H2O的电离平衡常数Kb=2×10-5,H2C2O4的电离平衡常数Ka1=5×10-2,Ka2=5×10-5)
NH3·H2O+HC2O4-的平衡常数K=________________________。(已知常温下,NH3·H2O的电离平衡常数Kb=2×10-5,H2C2O4的电离平衡常数Ka1=5×10-2,Ka2=5×10-5)
(5)在酸性电解质溶液中,以惰性材料作电极,将CO2转化为丙烯的原理如下图所示
①太阳能电池的负极是__________(填“a”或“b”)
②生成丙烯的电极反应式是_____________________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com