

| 氢氧化物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Mg(OH)2 | 9.3 | 10.8 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)3 | 2.7 | 3.7 |
| Al(OH)3 | 3.7 | 4.7 |
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |

分析 硼镁泥主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,加入硫酸,MgO、CaO、MnO、Fe2O3、FeO、Al2O3都和硫酸反应,SiO2不与硫酸反应,次氯酸钠具有强氧化性,加入的NaClO可与Mn2+反应生成MnO2,把Fe2+氧化成Fe3+,溶液pH升高,在pH为5-6时Fe3+生成Fe(OH)3沉淀,Al3+形成Al(OH)3沉淀,过滤除去滤渣Fe(OH)3、Al(OH)3、MnO2、SiO2,滤液中含钙离子、镁离子,除钙后,只剩镁离子,蒸发冷却结晶得到硫酸镁晶体;
(1)为加快反应速率,可以采用升高温度、适当增大反应物浓度、增大反应物接触面积等方法;
(2)次氯酸根离子具有氧化性,亚铁离子具有还原性,二者发生氧化还原反应生成氯离子、氢氧化铁沉淀;
(3)滤渣的主要成份除含有Fe(OH)3、Al(OH)3、MnO2外,还有SiO2,故答案为:SiO2;
(4)“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,其操作是蒸发浓缩、趁热过滤;“操作I”是将滤液继续蒸发浓缩,冷却结晶,过滤洗涤,
故答案为:趁热过滤;过滤洗涤;
(5)实验中提供的硼镁泥共100g,m(MgO)=100g×40%=40g,n(Mg)=n(MgO)=$\frac{40g}{40g/mol}$=1mol,根据Mg原子守恒得n(MgSO4•7H2O)=n(Mg)=n(MgO)=1mol,m(MgSO4•7H2O)=1mol×246g/mol=246g,其产率=$\frac{实际硫酸镁晶体质量}{理论硫酸镁晶体质量}×100%$;
(6)利用Mg防止Fe被腐蚀,可以采用牺牲阳极的阴极保护法或外加电源的阴极保护法,让Mg作正极或阳极.
解答 解:硼镁泥主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,加入硫酸,MgO、CaO、MnO、Fe2O3、FeO、Al2O3都和硫酸反应,SiO2不与硫酸反应,次氯酸钠具有强氧化性,加入的NaClO可与Mn2+反应生成MnO2,把Fe2+氧化成Fe3+,溶液pH升高,在pH为5-6时Fe3+生成Fe(OH)3沉淀,Al3+形成Al(OH)3沉淀,过滤除去滤渣Fe(OH)3、Al(OH)3、MnO2、SiO2,滤液中含钙离子、镁离子,除钙后,只剩镁离子,蒸发冷却结晶得到硫酸镁晶体;
(1)为加快反应速率,可以采用升高温度、适当增大反应物浓度、增大反应物接触面积等方法,如适当升高温度、把硼镁泥粉碎、或搅拌、或适当增加硫酸浓度,
故答案为:适当升温、把硼镁泥粉碎、或搅拌、或适当增加硫酸浓度;
(2)次氯酸根离子具有氧化性,亚铁离子具有还原性,二者发生氧化还原反应生成氯离子、氢氧化铁沉淀,离子方程式为2Fe2++ClO-+5H2O=2Fe(OH)3↓+Cl-+4H+,故答案为:2Fe2++ClO-+5H2O=2Fe(OH)3↓+Cl-+4H+;
(3)滤渣的主要成份除含有Fe(OH)3、Al(OH)3、MnO2外,还有二氧化硅;
(4)“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,其操作是蒸发浓缩、趁热过滤;.“操作I”是将滤液继续蒸发浓缩,冷却结晶,过滤洗涤;
(5)实验中提供的硼镁泥共100g,m(MgO)=100g×40%=40g,n(Mg)=n(MgO)=$\frac{40g}{40g/mol}$=1mol,根据Mg原子守恒得n(MgSO4•7H2O)=n(Mg)=n(MgO)=1mol,m(MgSO4•7H2O)=1mol×246g/mol=246g,其产率=$\frac{实际硫酸镁晶体质量}{理论硫酸镁晶体质量}×100%$=$\frac{172.2g}{246g}$×100%=70%或0.70,故答案为:70%或0.70;
(6)利用Mg防止Fe被腐蚀,可以采用牺牲阳极的阴极保护法或外加电源的阴极保护法,让Mg作正极或阳极,
图为 ,故答案为:
,故答案为: .
.
点评 本题考查物质分离和提纯的综合应用,为高频考点,涉及基本操作、除杂、原电池和电解池原理、氧化还原反应、化学反应速率影响因素等知识点,侧重考查基本操作及基本理论,明确化学反应原理、物质性质、物质分离提纯方法是解本题关键,注意题给信息的灵活运用,知道流程图中发生的反应及基本操作方法,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | CS2为V形分子 | B. | NCl3的空间构型为平面三角形 | ||
| C. | SF6中有4对完全相同的成键电子对 | D. | SiF4和H2O的中心原子均为sp3杂化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2与于恒容容器中生成1molN2O4 | B. | NO2与于恒压容器中生成1molN2O4 | ||
| C. | N2O4与于恒容容器中生成1molNO2 | D. | N2O4与于恒压容器中生成1molNO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
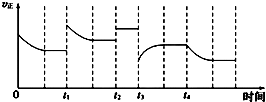 合成氨反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,在反应过程中,正反应速率的变化如图,下列说法中正确的是( )
合成氨反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,在反应过程中,正反应速率的变化如图,下列说法中正确的是( )| A. | t1时升高了温度 | |
| B. | t2时恒压条件下加入了惰性气体 | |
| C. | t3时增大了压强 | |
| D. | t2、t3、t4三个时刻中t4时NH3的百分含量最低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 显蓝色,无现象,显黄色 | B. | 显蓝色,有红色沉淀,无现象 | ||
| C. | 无现象,凝结,显黄色 | D. | 无现象,有红色沉淀,显黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Fe、S | B. | Cu、Fe | C. | Fe、O | D. | Fe、Cu |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com