
分析 (1)石灰石与盐酸反应生成氯化钙和水、二氧化碳;
(2)氢氧化铁与硫酸反应生成硫酸铁和水;
(3)二氧化碳少量反应生成碳酸钙和水.
解答 解:(1)石灰石与盐酸反应生成氯化钙和水、二氧化碳,离子方程式:CaCO3+2H+=Ca2++H2O+CO2↑,
故答案为:CaCO3+2H+=Ca2++H2O+CO2↑;
(2)氢氧化铁与硫酸反应生成硫酸铁和水,离子方程式:Fe(OH)3+3H+=Fe3++3H2O,
故答案为:Fe(OH)3+3H+=Fe3++3H2O;
(3)向澄清石灰水中通入少量的二氧化碳,离子方程式:Ca2++2OH-+CO2═CaCO3↓+H2O,
故答案为:Ca2++2OH-+CO2═CaCO3↓+H2O.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写是解题关键,注意化学式的拆分,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 变质的植物油有难闻的气味,是因为植物油发生了酯化反应 | |
| B. | 水煤气的主要成分是丁烷 | |
| C. | 石油是混合物,其分馏产品汽油为纯净物 | |
| D. | 石油催化裂化的主要目的是提高汽油等轻质油的产量与质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图,有甲、乙两容器,甲保持恒压,乙保持恒容,分别向其中充入1mol A、3mol B发生可逆反应:A(g)+3B(g)?2C(g)+D(s),下列说法正确的是( )
如图,有甲、乙两容器,甲保持恒压,乙保持恒容,分别向其中充入1mol A、3mol B发生可逆反应:A(g)+3B(g)?2C(g)+D(s),下列说法正确的是( )| A. | 当乙中混合气体总质量不再变化时即达到化学平衡 | |
| B. | 达平衡时用A表示反应速率时,v(甲)<v(乙) | |
| C. | 由于容器甲的容积在不断变化,故从反应开始到平衡所需时间比容器乙要长 | |
| D. | 达到平衡时,甲所需时间短,但两容器中A的转化率相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
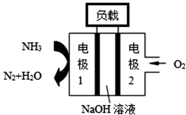 (1)已知
(1)已知查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增加 | |
| B. | 对于有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增大活化分子的百分数,从而使反应速率增大 | |
| C. | 改变条件能使化学反应速率增大的主要原因是增大了反应物分子中活化分子的有效碰撞几率 | |
| D. | 对于本来不能发生的化学反应,改变条件可以使反应发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.12g | B. | 4.18g | C. | 4.68g | D. | 5.08g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
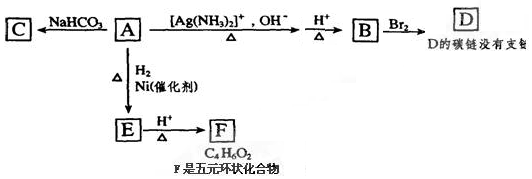
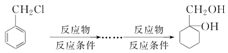
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com