
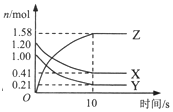
 在2L的密闭绝热容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列叙述不正确的是( )
在2L的密闭绝热容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列叙述不正确的是( )| A. | 反应开始到10s时,转化率:Y>X | |
| B. | 若前10s容器内的压强增加,说明生成Z的反应为放热反应 | |
| C. | 由图象可知前10s内生成Z的速率越来越快 | |
| D. | 若X为紫色,Y、Z无色,则10s后混合气体颜色不再变化 |
分析 由图表可知,随反应进行X、Y的物质的量减小,Z的物质的量增大,所以X、Y是反应物,Z是生产物,l0s后X、Y、Z的物质的量为定值,不为0,反应是可逆反应,且△n(X):△n(Y):△n(Z)=(1.20-0.41)mol:(1.00-0.21)mol:1.58mol=1:1:2,参加反应的物质的物质的量之比等于化学计量数之比,故反应化学方程式为X(g)+Y(g)?2Z(g),结合转化率概念、化学反应速率、化学平衡及其影响分析.
解答 解:由图表可知,X、Y的物质的量减小,Z的物质的量增大,则X、Y是反应物,Z是生产物,l0s后X、Y、Z的物质的量为定值,不为0,该反应是可逆反应,且△n(X):△n(Y):△n(Z)=(1.20-0.41)mol:(1.00-0.21)mol:1.58mol=1:1:2,则反应方程式为:X(g)+Y(g)?2Z(g),
A.反应X(g)+Y(g)?2Z(g)中X、Y消耗的物质的量相等,由于初始时X的物质的量较大,则反应开始到10s时转化率:Y>X,故A正确;
B.反应X(g)+Y(g)?2Z(g)前后气体体积不变,则反应过程中若温度不变则压强不变,由于随着反应的进行若前10s容器内的压强增加,说明容器内温度升高,则该反应为放热反应,故B正确;
C.图象中曲线Z的斜率逐渐减小,其斜率表示的是反应速率,则前10s内生成Z的速率逐渐减小,故C错误;
D.10s后达到平衡状态,各组分的浓度不再变化,则混合气体颜色不再变化,故D正确;
故选C.
点评 本题考查了化学平衡的计算与应用,题目难度中等,涉及转化率、反应热、反应速率、化学平衡状态判断等知识,明确化学平衡及其影响为解答关键,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:多选题
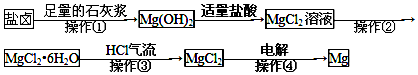
| A. | 操作①--③是为了获得无水氯化镁 | |
| B. | 操作④发生了氧化还原反应 | |
| C. | 操作②是冷却结晶 | |
| D. | 若在实验室进行操作①只需要漏斗和烧杯两种玻璃仪器 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 太阳能、氢能、风能、地热能、海洋能和生物质能等属于新能源 | |
| B. | 根据能量守恒定律,生成物总能量一定等于反应物总能量 | |
| C. | 放热反应在常温下一定很容易发生 | |
| D. | 吸热反应在常温下一定不能发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氨汽化时要吸收大量的热,常用作制冷剂 | |
| B. | 加快清洁能源发展、加强污染物达标排放检查是治理雾霾的有效措施 | |
| C. | 为使水果保鲜,可在水果箱内放入高锰酸钾溶液浸泡过的硅藻土 | |
| D. | 氢氧化铝、碳酸钠都是常见的胃酸中和剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | NaHCO3的电离方程式:NaHCO3═Na++H++CO32- | |
| C. | Fe与盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| D. | Ba(OH)2和CuSO4溶液反应:Cu2++SO42-+Ba2++2OH-═BaSO4↓+Cu(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com