
【题目】物质X在一定条件下可转化为物质Y或物质Z:
![]()
![]()
两个反应的能量变化如图所示,下列说法正确的是
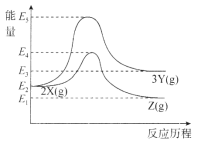
A.两个反应均为放热反应
B.X、Y、Z的关系是互为同素异形体或同分异构体
C.X转化为Y的活化能高于X转化为Z的活化能
D.其它条件一定,加压有利于提高X转化为Z的速率和平衡转化率
科目:高中化学 来源: 题型:
【题目】某试液中只可能含有K+、NH4+、Fe2+、Al3+、Cl-、SO42-、CO32-、AlO2-中的若干种离子,离子浓度均为0.1mol·L-1,某同学进行了如下实验,下列说法正确的是

A. 无法确定原试液中是否含有Al3+、Cl-
B. 原溶液中存在NH4+、Fe2+、Cl-、SO42-
C. 无法确定沉淀C的成分
D. 滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)有机物命名:
![]() ________________________________;
________________________________;
![]() ___________________________________;
___________________________________;
(2)依据名称写出物质:
3,4-二甲基-4-乙基庚烷 ______________;3,4,4-三甲基-1-戊炔 ______________。
(3)已知有机物降冰片二烯的分子结构可表示为: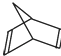
①降冰片二烯的分子式为 ______________;②降冰片二烯属于 __________;
a.环烃 b.不饱和烃 c.烷烃 d.烯烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z在元素周期表中的位置如图所示,下列说法正确的是( )
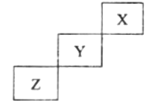
A.非金属性强弱: Z> Y
B.气态氢化物的稳定性: Y>Z
C.最高价氧化物的水化物酸性: Y>Z
D.常压下X的单质化学性质非常活泼
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全钒液流电池是一种新型储能电池,具有充放电可逆性高、能量转化效率高等优点,其结构如图所示,放电时电极a发生氧化反应。下列说法错误的是
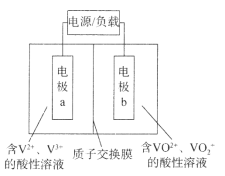
A.充电时电极a应连接电源的负极
B.放电时电极b发生的反应为![]() +e-+2H+=VO2++H2O
+e-+2H+=VO2++H2O
C.放电时电极a附近溶液pH不发生变化
D.充电时H+从质子交换膜右侧向左侧移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下向10mL0.1mol/L的NaCN溶液中滴加等浓度的盐酸(忽略体积和温度变化),δ(HCN)和![]() 随溶液pH变化的图像如图所示,下列说法错误的是
随溶液pH变化的图像如图所示,下列说法错误的是
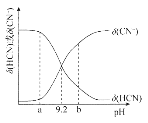
A.常温下HCN的电离常数为l0-9.2
B.pH为9.2时,加入盐酸的体积大于5mL
C.pH为a时溶液中c(Cl-)大于pH为b时溶液中c(Cl-)
D.滴加过程中可能出现:c(Na+)>c(CN-)>c(OH-)>c(Cl-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。下图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化。
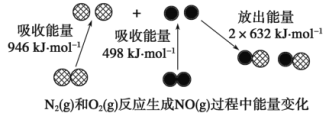
下列说法正确的是
A.1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJ
B.1molN2(g)和1molO2(g)具有的总能量小于2molNO(g)具有的总能量
C.通常情况下,N2(g)和O2(g)混合能直接生成NO
D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表的形式多种多样,下图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,并回答下列问题:
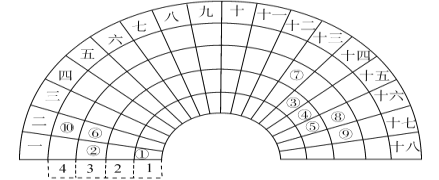
(1)若①~⑩分别代表十种元素,则⑩代表的元素处于常见周期表的位置是_______________________;
(2)⑥⑦为生活中两种常见的金属,其最高价氧化物对应水化物的碱性:⑥____⑦(填>、<或=);比较元素⑧⑨对应的常见单质氧化性的强弱,并用化学方程式证明:____________________________________;
(3)①③⑤三种元素形成的18电子结构化合物是近年来燃料电池研究领域的新宠,写出用它作燃料,②最高价氧化物对应的水化物作为电解质的燃料电池的负极反应式:___________________________;
(4)用电子式表示④的一种10电子结构氢化物的形成过程:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以含银废液{主要含[Ag(NH3)2]+、[Ag(S2O3)2]3-}为原料制取硝酸银晶体,其实验流程如下:

已知:①“沉银”所得AgCl中含有少量PbCl2、Ag2S。
②Zn2+在浓氨水中以[Zn(NH3)4]2+形式存在。
③PbCl2、AgNO3的溶解度曲线如图所示:

(1)“滤液”中的主要阳离子为___(填化学式)。
(2)“除杂”分为两步:先除去PbCl2,再除去Ag2S。
①在不同温度下,AgCl、Ag2S均难溶于水。 除去PbCl2的操作为______,热水洗涤。
②向热水洗涤所得固体中加入浓硝酸和稀盐酸,边加热边充分搅拌,使Ag2S转变为AgCl。加入浓硝酸的目的是_______。
(3)室温下,可逆反应AgCl+2NH3·H2O[Ag(NH3)2]++Cl-+2H2O的平衡常数K=___。{Ksp(AgCl)= 1.8×10-10,Ag++2NH3·H2O[Ag(NH3)2]++2H2O的平衡常数为1.1×107}
(4)“还原”过程中发生反应的离子方程式为_____ 。
(5)粗银经水洗后,经多步处理可制备硝酸银晶体。请补充完整由以水洗后粗银为原料,制备硝酸银晶体的实验方案:________,过滤,________,将产生的气体和空气混合后通入NaOH溶液进行尾气处理,将所得AgNO3溶液_______,过滤,将所得晶体置于烘箱 (120℃)干燥,密封包装。(实验中须使用的试剂:稀硫酸、稀硝酸、BaC12溶液)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com