
| A. | 等浓度的三种溶液:醋酸钠溶液pH=a,碳酸氢钠溶液pH=b,碳酸钠溶液pH=c,则c>a>b | |
| B. | 在滴有酚酞溶液的氨水中,加入NH4Cl的溶液恰好无色,则此时溶液pH=7 | |
| C. | MgCl2溶液蒸发、结晶得MgCl2•6H2O | |
| D. | 常温下,若1mL pH=1盐酸与100mL NaOH溶液混合后,溶液pH=7,则NaOH溶液的pH=11 |
分析 A、根据酸性的强弱比较对应强碱弱酸盐的水解程度大小;
B、根据酚酞的变色范围分析;
C、MgCl2溶液蒸发促进镁离子水解;
D、溶液pH=7,则酸碱中和时酸碱的物质的量相等.
解答 解:A、已知酸性:H2CO3>苯酚>HCO3-,酸越弱,对应的钠盐水解程度越大,溶液的PH越大,所以有c>a>b,故A正确;
B、酚酞的变色范围为8~10,在滴有酚酞溶液的氨水中,加入NH4Cl的溶液恰好无色,溶液的PH可能大于7,故B错误;
C、MgCl2溶液蒸发促进镁离子水解,同时HCl挥发,最终得到氢氧化镁,不能得到得MgCl2•6H2O,故C错误;
D、溶液pH=7,则酸碱中和时酸碱的物质的量相等,在常温下,c(OH-)=$\frac{0.001L×0.1mol/L}{0.1L}$=0.001mol/L,则NaOH溶液的pH=11,故D正确.
故选AD.
点评 本题考查酸碱混合的判断以及酸性强弱的比较、盐的水解等问题,题目较为综合,题目难度中等,注意酸碱指示剂的变色范围、溶液的PH与温度的关系等问题.


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液的 pH=4 | |
| B. | 升高温度,溶液的 pH 增大 | |
| C. | 此酸的电离平衡常数约为 1×10-7 | |
| D. | 由 HA 电离出的 c(H+)约为水电离出的 c(H+)的106倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
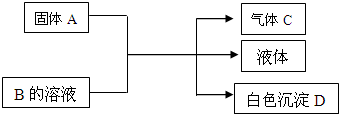 A、B、C、D均为中学化学常见的物质,它们间的反应关系如图所示.
A、B、C、D均为中学化学常见的物质,它们间的反应关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu与FeCl3溶液的反应:Cu+2Fe3+═Cu2++2Fe2+ | |
| B. | Na2SiO3溶液中加入盐酸:Na2SiO3+2H+═H2SiO3↓+2Na+ | |
| C. | AgCl悬浊液中加入KI溶液得到黄色沉淀:Ag++I-═AgI↓ | |
| D. | AlCl3溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径 | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| 最低化合价 | -2 | -3 | -1 | -3 |
| A. | ③和⑥、④和⑦分别处于同一主族 | |
| B. | 元素④处于第三周期ⅤA族 | |
| C. | 元素①与元素⑥形成的化合物中不可能存在共价键 | |
| D. | 元素⑧对应的氢氧化物可能具有两性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com