
| A. | 34S原子核内中子数为16 | B. | 2H+的酸性比1H+的酸性更强 | ||
| C. | 16O与18O的化学性质几乎完全相同 | D. | 13C和15N原子核内的质子数相差2 |
分析 A、利用质子数+中子数=质量数来计算;
B、2H+与1H+都是氢离子,化学性质相同;
C、同位素原子核外电子数相同最外层电子数相同;
D、C原子的质子数为6,N原子的质子数为7.
解答 解:A、34S原子核内的中子数为34-16=18,故A错误;
B、2H+与1H+都是氢离子,化学性质相同,即2H+的酸性与1H+的酸性相同,故B错误;
C、16O与18O为氧元素同位素,原子最外层电子数相同,化学性质几乎完全相同,故CV正确;
D、C原子的质子数为6,N原子的质子数为7,则13C和15N原子核内的质子数相差7-6=1,故C错误;
故选C.
点评 本题以信息来考查同位素及原子的构成等知识,题目难度中等,属于基础知识的考查,明确原子中的量的关系及同位素性质、氢离子酸性的方法即可解答.


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,2.8 g N2和CO的混合气体所含原子数为0.2 NA | |
| B. | 1 mol Cl2与足量Fe完全反应,转移3NA个电子 | |
| C. | 1 L 0.1 mol•L-1NaHCO3溶液中含有0.1 NA个HCO3- | |
| D. | 常温常压下,22.4L乙烯中C-H键数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠溶液呈碱性,可用热的纯碱溶液除去矿物油污 | |
| B. | 氧化铝的熔点很高,可用于制作耐高温材料 | |
| C. | C12、SO2均有漂白性,可使紫色石蕊溶液褪色 | |
| D. | 钠的金属性强于钾,工业上可用钠制取钾Na+KCl$\frac{\underline{\;850℃\;}}{\;}$K↑+NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
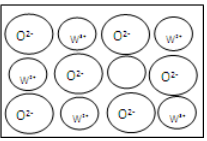 X、Y、Z、W四种元素原子序数依次增大且均小于36.Z基态原子最外层电子数是其内层电子总数的3倍,Y基态原子是同周期元素中未成对电子数最多的原子,X分别与Y、Z元素组合均可形成10电子微粒,W基态原子有10个价电子. 回答下列问题(以下问题均以推知元素符号作答):
X、Y、Z、W四种元素原子序数依次增大且均小于36.Z基态原子最外层电子数是其内层电子总数的3倍,Y基态原子是同周期元素中未成对电子数最多的原子,X分别与Y、Z元素组合均可形成10电子微粒,W基态原子有10个价电子. 回答下列问题(以下问题均以推知元素符号作答):查看答案和解析>>
科目:高中化学 来源: 题型:推断题
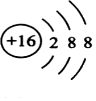 .
.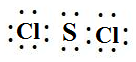 ,该反应的化学方程式为3SCl2+4H2O=2S+H2SO4+6HCl.
,该反应的化学方程式为3SCl2+4H2O=2S+H2SO4+6HCl.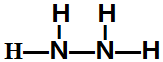 .常温下,液体乙与气体丙反应生成两种无污染的物质,若共生成1mol产物时放热QKJ,该反应的热化学方程式为2N2H4(l)+2NO2(g)=3 N2(g)+4H2O(l)△H=-7QkJ/mol.
.常温下,液体乙与气体丙反应生成两种无污染的物质,若共生成1mol产物时放热QKJ,该反应的热化学方程式为2N2H4(l)+2NO2(g)=3 N2(g)+4H2O(l)△H=-7QkJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应a为:2Fe3++2I-?2Fe2++I2 | B. | Ⅱ中,反应a进行的程度大于反应b | ||
| C. | 比较氧化性:Ⅱ中,I2>Fe3+ | D. | 比较水溶液中c(Fe2+):Ⅱ<Ⅲ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 松油醇的结构简式为 ,则其同分异构体可能属于醛类、酮类或芳醇类 ,则其同分异构体可能属于醛类、酮类或芳醇类 | |
| B. | 甲烷和氯气的反应与乙烯和Br2的反应属于同一类型的反应 | |
| C. | 分子式为C4H8O2且能与氢氧化钠溶液反应的有机物(不考虑立体异构和醛类物质)有6种 | |
| D. | 乙醇、乙酸均能与NaOH溶液反应,因为分子中均含有-OH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com